ВВЕДЕНИЕ
Цистит – одна из самых распространенных форм инфекций мочевыводящих путей (ИМП). Результаты эпидемиологических исследований показывают, что хотя бы один эпизод острого цистита переносят в течение жизни более 50% женщин [1]. Высокую частоту возникновения цистита именно у женщин связывают с анатомическими, физиологическими и гормональными особенностями женского организма [1-3].
Важная особенность цистита – склонность к хроническому рецидивированию. Установлено, что после первого клинического проявления ИМП у 25% женщин рецидив развивается в течение полугода, у 40% – в течение одного года, а примерно у половины женщин, оказавшихся на приеме у врача по поводу ИМП, определяют уже рецидивирующую форму заболевания [4, 5]. До настоящего времени антибиотики остаются «золотым стандартом» лечения и профилактики рецидивирования ИМП. Однако их длительное применение приводит к росту числа осложнений и селекции микроорганизмов, резистентных к антибиотикам. По некоторым подсчетам, к 2050 году заболевания, вызванные антибиотико-резистентными штаммами микроорганизмов, будут ежегодно приводить к примерно 10 млн. смертей [6]. Поэтому поиск безопасной и эффективной стратегии лечения и профилактики рецидивирующего цистита является крайне актуальной проблемой.
Один из перспективных вариантов решения данной проблемы, помимо рационального подхода к использованию антибактериальных средств, – это поиск альтернативных антибиотикам методов лечения и профилактики. В настоящее время комплексы, содержащие D-маннозу, зарекомендовали себя как один из подобных вариантов терапии хронического цистита.
D-манноза — это моносахарид, который естественным образом вырабатывается организмом из глюкозы. Он присутствует в клетках организма и в некоторых продуктах питания. D-манноза отличается от глюкозы инверсией одного из четырех хиральных центров молекулы, а именно того, что расположен у атома углерода в положении 2 [7].
По меньшей мере 90% принятой D-маннозы всасывается в верхних отделах кишечника. Его особенность в том, что, несмотря на простое строение, этот углевод не метаболизируется в организме человека. Следовательно, он не накапливается в печени или других органах, а выводится в непревращенном виде с мочой. Примерно через 60 мин после приема внутрь он поступает в мочевые пути в неизмененном виде [8].
Одним из комплексов в состав которого входят: D-манноза в дозировке 2500 мг, олигомерные проантоцианидины из экстракта виноградных косточек, арбутин из экстракта Толокнянки обыкновенной и витамин С является «Цисталис® Д Плюс».
Целью настоящего исследования является сравнение эффективности Цисталис® Д Плюс с антибиотикотерапией в отношении купирования обострения хронческого рецидивирующего цистита.
МАТЕРИАЛЫ И МЕТОДЫ
В исследование были включены 120 пациенток в возрасте от 18 до 45 лет. Критериями включения стали: типичные для цистита жалобы (боль внизу живота, учащенное болезненное мочеиспускание), бактериурия и/или лейкоцитурия в общем анализе мочи, положительный посев мочи. Уровень боли оценили с помощью визуально-аналоговой шкалы (ВАШ). С учетом наличия двух обострений цистита в течение полугода или трех в течение года всем пациентам поставили диагноз хронический цистит.
Все пациентки были разделены на 4 группы:
- Первая группа (n = 30) получала препарат «Цисталис® Д Плюс» на регулярной основе по одному саше (3,2 г) 1 раз в день в течение 7 дней с последующим наблюдением в течение 3 недель.
- Вторая группа (n = 30) получала препарат «Цисталис® Д Плюс» на регулярной основе по одному саше (3,2 г) 1 раз в день в течение 7 дней в сочетании с ибупрофеном по 400 мг 3 раза в сутки в течение 7 дней или в сочетании с феназопиридина гидрохлоридом по 100 мг по 2 таблетки 3 раза в день в течение 2-х дней с последующим наблюдением в течение 3-х недель.
- Третья группа (n = 30) получала фосфомицина трометамол 3 г однократно в сочетании с ибупрофеном по 400 мг 3 раза в сутки в течение 7 дней или в сочетании с феназопиридина гидрохлоридом по 100 мг по 2 таблетки 3 раза в день в течение 2-х дней с последующим наблюдением в течение 3-х недель.
- Четвертая группа (n = 30) получала фосфомицина трометамол 3 г однократно с последующим наблюдением в течение 3-х недель.
Основные клинико-лабораторные показатели в группах к началу лечения достоверно не отличались. Общая длительность наблюдения составила 1 месяц.
Таблица 1. Сравнительная характеристика групп больных, получающих различное лечение
Table 1. Comparative characteristics of groups of patients receiving different treatments
| Параметр Characteristics |
Группа 1 (M±m) Group 1 (M±m) |
Группа 2 (M±m) Group 2 (M±m) |
Группа 3 (M±m) Group 3 (M±m) |
Группа 4 (M±m) Group 4 (M±m) |
Значимость различия между группами Significance of the difference between groups |
|---|---|---|---|---|---|
| Возраст, лет Age, years |
39,0±18,64 | 39,1±21,59 | 34,05±12,28 | 34,42±15,14 | 0,634 |
| Время до начала возникновения симптомов, ч. Time before the start of the symptoms, h. | 3,35±0,69 | 3,3±0,88 | 3,4±0,72 | 3,45±0,62 | 0,847 |
| ВАШ, баллы VAS, points |
6,22±1,31 | 6,4±1,06 | 7,05±1,19 | 6,78±1,31 | 0,125 |
| ACSS, баллы ACSS, points |
16,79±2,6 | 17,6±3,44 | 18,47±4,06 | 18,29±3,04 | 0,109 |
| Выраженность объективных симптомов* Severity of objective symptoms* | 2,73±0,46 | 2,4±0,52 | 2,8±0,42 | 2,8±0,42 | 0,162 |
| Лейкоциты в осадке мочи, кл в п/зр WBC |
56,59±31,86 | 53,73±30,88 | 70,3±32,48 | 63,93±33,36 | 0,164 |
| Обсемененность мочи, КОЕ/мл Colony count, CFU/ml |
5,68±1,08 | 5,2±0,94 | 5,9±1,12 | 5,39±0,7 | 0,166 |
| Бактерии в осадке мочи, кл в п/зр* Urine sediment bacteria count | 2±1,03 | 2,47±0,83 | 2,1±0,74 | 2±0,82 | 0,406 |
* При оценке полуколичественных переменных значение «++++» перекодировалось в 4, «+++» – в 3, «++» – в 2, «+» – в 1, «отрицательно» – в 0
* When assessing semi-quantitative variables, the value «++++» was recoded into 4, «+++» into 3, «++» into 2, «+» into 1, «negative» into 0
С целью стандартизации вводимых данных и возможности статистической обработки значение числа лейкоцитов в полях зрения «сплошь» или «большое количество» принималось за 100. При интервальных значениях (например, «10-20 в поле зрения») рассчитывалось среднее арифметическое значение из максимального и минимального значений.
С целью количественной оценки и межгруппового сравнения полуколичественным показателям (оценка болезненности в надлобковой области, содержание бактерий в осадке анализа мочи) присваивались численные значения.
Так как время, прошедшее с момента появления симптомов до начала лечения, может существенно повлиять на его эффективность, пациентки отмечали время от начала симптомов до обращения к врачу (менее 6 часов, 6-12 часов, 12-24 часа, более 24 часов).
Для оценки выраженности симптоматики цистита применялась Шкала оценки симптомов острого цистита (Acute Cystitis Symptom Score – ACSS) [9]. Анкета состоит из 18 пунктов, построенных в виде порядковых и интервальных шкал, разделенных на 4 секции: a) «Typical», содержащую 6 пунктов, касающихся наиболее типичных симптомов острого цистита; b) «Differential», включающую 4 пункта о симптомах, касающихся других распространенных урогенитальных патологий; c) «Quality of life», состоящую из 3-х пунктов, касающихся влияния симптомов на качество жизни опрашиваемых; d) «Additional», содержащую 5 пунктов, позволяющих выявлять дополнительную информацию о состояниях, способных осложнять течение заболевания и/или влиять на выбор терапии.
В качестве исследуемой терапии был выбран комплекс «Цисталис® Д Плюс», содержащий 2500 мг D-маннозы, экстракт толокнянки (лат. Arctostáphylos úva-úrsi), стандартизированный по содержанию арбутина (10%), экстракт виноградной косточки, стандартизированный по содержанию олигомерных проантоцианидинов (98%), аскорбиновую кислоту.
Для оценки различий внутри группы в разные периоды времени применялся двухфакторный ранговый дисперсионный анализ Фридмана для связанных выборок. Для межгрупповых сравнений применялся t-критерий для несвязанных выборок, в случае нормального распределения данных, и U-критерий Манна– Уитни для независимых выборок – если распределение признака отличалось от нормального.
РЕЗУЛЬТАТЫ
Оценка боли по ВАШ
Уже на третий день лечения пациенты во всех группах отметили значительное снижение интенсивности боли по ВАШ. В группе 1, принимавшей «Цисталис® Д Плюс» в режиме монотерапии на 3, 7 и 30 дни после лечения оценка боли во ВАШ снизилась на 52,6, 69,6 и 74,3% соответственно (p<0,001). При сочетании «Цисталиса® Д Плюс» с феназопиридином или нестероидным противовоспалительным средством (НПВС) эффективность увеличивается до 65,6, 75,0, 84,4%, на 3, 7 и 30 сутки соответственно. Наиболее выраженно на 3 и 7 сутки интенсивность боли снижалась в группе, получавшей фосфомицина трометамол и феназопиридин. Однако после 7 суток лечения выраженность боли была сопоставима во всех группах (табл. 2).
Таблица 2. Оценка боли по ВАШ (баллы) в группах больных, получающих различное лечение
Table 2. Pain assessment according to VAS (scores) in groups of patients receiving different treatments
| Группа Group |
До лечения Before treatment |
3 сутки 3 days |
7 сутки 7 days |
30 сутки 30 days |
р* |
|---|---|---|---|---|---|
| 1 | 6,22±1,31 | 2,95±0,95 | 1,89±1,19 | 1,6±1,34 | <0,001 |
| 2 | 6,4±1,06 | 2,2±0,42 | 1,6±1,12 | 1±1 | <0,001 |
| 3 | 7,05±1,19 | 1,7±0,48 | 1,05±0,89 | 0,8±0,42 | <0,001 |
| 4 | 6,78±1,31 | 2,3±0,48 | 1,28±0,89 | 0,75±0,71 | <0,001 |
| Межгрупповое различие Significance between groups |
р=0,125 | р<0,001 | р=0,046 | р=0,295 |
р* Значимость изменения со временем, до лечения vs. 3 сутки;
р* Significance of change within time, before treatment vs. 3 days
Оценка симптоматики по ACSS
Во всех группах уже на 3, 7 и 30 день после начала терапии отмечалось достоверное снижение выраженности симптомов острого цистита по шкале ACSS. В группе 1, получавшей только «Цисталис® Д Плюс» оценка по шкале ACSS снизилась на 63,9, 74,2 и 82,5% соответственно (p<0,001). Результаты были сопоставимы с таковыми в остальных группах (рис. 1, табл. 3).
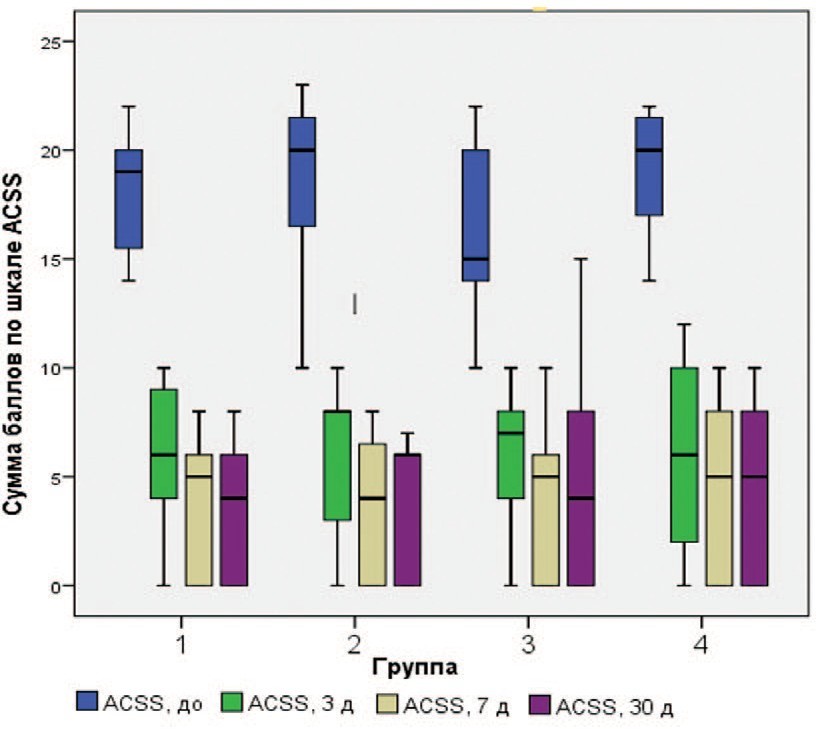
Рис. 1. Динамика выраженности симптомов цистита по шкале ACSS.
Fig. 1. Dynamics of the severity of cystitis symptoms on the ACSS scale
Таблица 3. Оценка симптоматики цистита по шкале ACSS в группах больных, получающих различное лечение
Table 3. ACSS assessment, points) in groups of patients receiving different treatments
Группа |
Оценка по шкале ACSS, баллы / ACSS, points |
р* |
|||
|---|---|---|---|---|---|
До лечения |
3 сутки |
7 сутки |
30 сутки |
||
1 |
18,3±2,7 |
6,1±3,3 |
3,8±3,3 |
3,3±3,2 |
<0,001 |
2 |
18,7±4,1 |
5,9±3,7 |
3,5±3,5 |
3,3±3,2 |
<0,001 |
3 |
16,2±3,9 |
6,0±3,6 |
4,0±3,8 |
5,1±4,9 |
<0,001 |
4 |
19,1±2,6 |
5,7±4,2 |
4,1±3,8 |
4,5±3,5 |
<0,001 |
Межгрупповое различие |
р=0,109 |
р<0,996 |
р=0,496 |
р=0,984 |
|
р* Значимость изменения со временем, до лечения vs. 3 сутки;
р* Significance of change within time, before treatment vs. 3 days
Динамика воспалительных изменений
Во всех группах отмечалось достоверное снижение уровня воспаления, выразившееся в уменьшении числа лейкоцитов в моче. Число лейкоцитов в полях зрения в группе, получавшей только «Цисталис® Д Плюс», на 3, 7, и 30 сутки снизилось на 82,3, 85,2, 89,8% соответственно. В других группах отмечались сопоставимые положительные изменения (рис. 2, табл. 4).
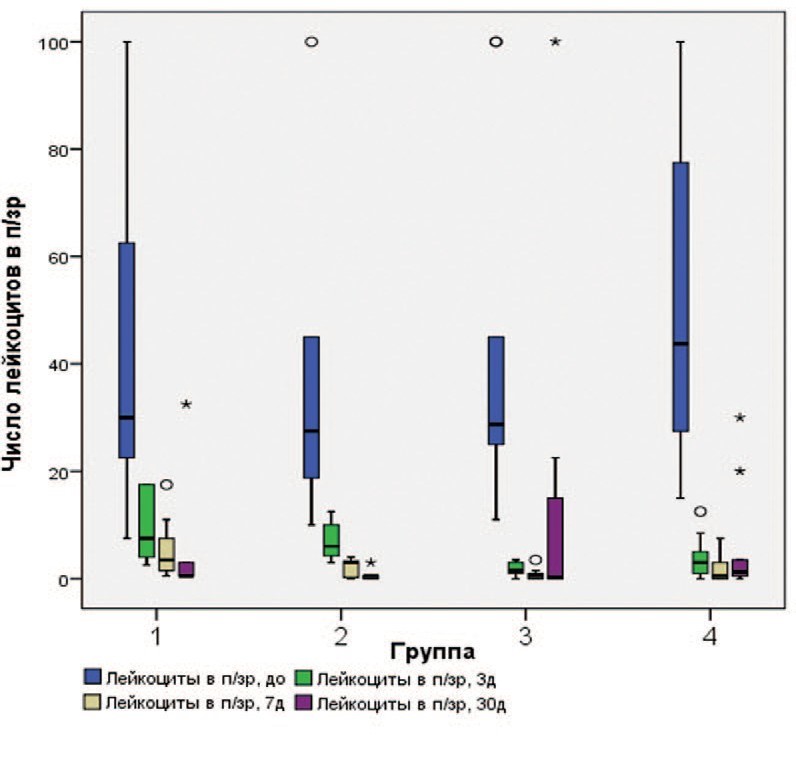
Рис. 2. Динамика лейкоцитурии в исследуемых группах
Fig. 2. Leukocyturia dynamics in groups
Таблица 4. Оценка воспалительных изменений в группах больных, получающих различное лечение
Table 4. Inflammatory changes assessment in groups of patients receiving different treatments
| Группа Group |
До лечения Before treatment |
3 сутки 3 days |
7 сутки 7 days |
30 сутки 30 days |
р* |
|---|---|---|---|---|---|
| 1 | 56,59±31,86 | 10,00±6,34 | 8,37±9,05 | 5,80±7,80 | <0,001 |
| 2 | 53,73±30,88 | 7,14±3,96 | 6,60±5,30 | 3,37±3,18 | <0,001 |
| 3 | 70,30±32,48 | 1,80±1,25 | 2,90±2,83 | 7,07±18,21 | <0,001 |
| 4 | 63,93±33,36 | 3,75±3,97 | 3,29±3,38 | 5,59±9,58 | <0,001 |
| Межгрупповое различие Significance between groups |
р=0,164 | р=0,001 | р<0,001 | р=0,607 |
р* Значимость изменения со временем, до лечения vs. 3 сутки;
р* Significance of change within time, before treatment vs. 3 days
Динамика микробной нагрузки
Все вошедшие в исследование пациентки имели положительный посев мочи до начала лечения. Самым распространенным возбудителем были Е. coli – 66,7%, Enterococcus sp. – 16,7%, Klebsiella pneumoniae – 8,3%. Через 30 дней частота положительного посева мочи составляла 53,7%. В группах 1 и 2, не получавших антибактериальной терапии, частота достижения отрицательного посева мочи составила 33,3% и 40%, соответственно. В группах 3 и 4, получавших фосфомицина трометамол, частота отрицательного посева мочи достигала 77% и 72,2%.
Степень микробной нагрузки по результатам посева мочи перед началом лечения достоверно не отличалась между группами, однако, при повторном анализе через 30 дней в исследуемых группах степень бактериурии сократилась на 71,9%, 67,3%, 91,5% и 90,7%, в группах 1, 2 ,3 и 4 соответственно (рис. 3, табл. 5-6).
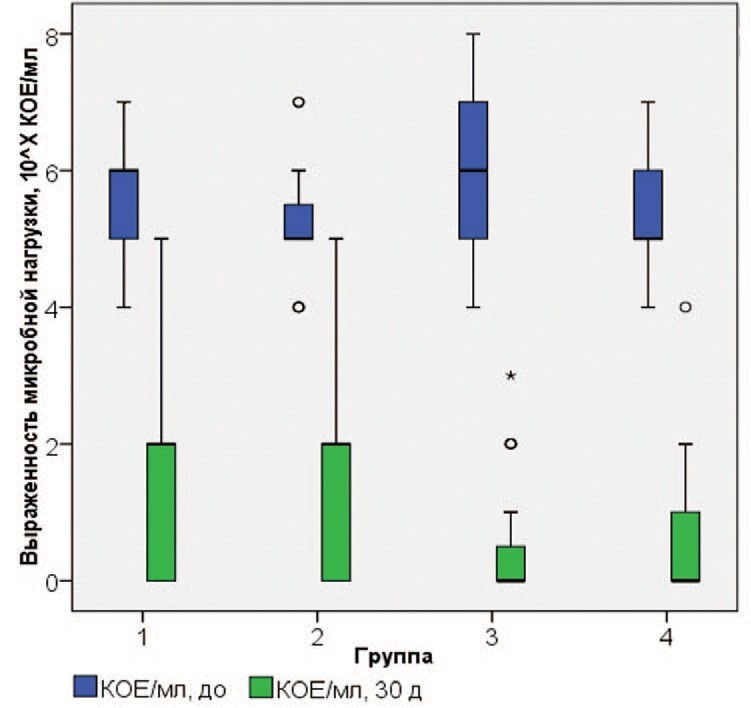
Рис. 3. Выраженность микробной нагрузки (КОЕ/мл) в группах больных, получающих различное лечение
Fig. 3. Severity of microbial load in groups of patients receiving different treatments
Таблица 5. Оценка результатов бактериологического исследования мочи (бактериурия, посев мочи) в группах больных, получающих различное лечение
Table 5. Bacteriological examination of urine results assessment (bacteriuria, urine culture) in groups of patients receiving different treatments
| Группа Group |
Штамм Strain |
До лечения Before treatment |
30 сутки 30 days |
|---|---|---|---|
| 1 | Е. coli | 20 | 12 |
| Enterococcus sp. | 5 | 3 | |
| K. pneumonia | 1 | 0 | |
| K. oxytoca | 2 | 1 | |
| Proteusmirabilis | 1 | 0 | |
| Другие / Other | 2 | 2 | |
| Нет роста / No growth | 0 | 9 | |
| 2 | Е. coli | 11 | 6 |
| Enterococcus sp. | 3 | 2 | |
| K. pneumonia | 1 | 1 | |
| Нет роста / No growth | 0 | 6 | |
| 3 | Е. coli | 14 | 4 |
| Enterococcus sp. | 2 | 0 | |
| K. pneumonia | 4 | 1 | |
| Нет роста / No growth | 0 | 15 | |
| 4 | Е. coli | 11 | 3 |
| Enterococcus sp. | 4 | 1 | |
| K. pneumonia | 1 | 1 | |
| K. oxytoca | 1 | 0 | |
| Другие / Other | 1 | 0 | |
| Нет роста / No growth | 0 | 13 |
Таблица 6. Выраженность микробной нагрузки в группах больных, получающих различное лечение
Table 6. Severity of microbial load in groups of patients receiving different treatments
| Группа Group |
Выраженность микробной нагрузки, 10^Х КОЕ/мл Severity of microbial load, 10^X CFU/ml | р* | |
|---|---|---|---|
| До лечения Before treatment |
30 сутки 30 days |
||
| 1 | 5,7±0,9 | 1,6±1,4 | <0,001 |
| 2 | 5,2±0,9 | 1,7±1,8 | <0,001 |
| 3 | 5,9±1,1 | 0,5±0,9 | <0,001 |
| 4 | 5,4±0,7 | 0,5±1,0 | <0,001 |
| Межгрупповое различие Significance between groups | p=0,166 | p=0,004 | |
р* Значимость изменения со временем, до лечения vs. 3 сутки;
р* Significance of change within time, before treatment vs. 3 days
Степень бактериурии достоверно отличалась между группами на 3 и 7 сутки (p=0,028 и p=0,009, соответственно). Вместе с тем, в группах 1 и 2, получавших Цисталис® Д Плюс, отмечалось достоверное снижение обсемененности мочи на 3 и 7 сутки после начала лечения. В группе 1 (Цисталис® Д Плюс) снижение на 3 и 7 сутки составило 65,0 и 75,0%, соответственно (p<0,001). В группе 2 (Цисталис® Д Плюс + НПВС/феназопиридин) снижение на 3 и 7 сутки составило 76 и 88%, соответственно (табл. 7).
Таблица 7. Выраженность бактериурии в группах больных, получающих различное лечение
Table 7. Bacteriuria grade in groups of patients receiving different treatments
| Группа Group |
До лечения Before treatment |
3 сутки 3 days |
7 сутки 7 days |
30 сутки 30 days |
р* |
|---|---|---|---|---|---|
| 1 | 2,0±1,0 | 0,7±0,7 | 0,5±0,6 | 0,3±0,7 | <0,001 |
| 2 | 2,5±0,8 | 0,6±0,7 | 0,3±0,5 | 0,3±0,6 | <0,001 |
| 3 | 2,1±0,7 | 0,4±0,5 | 0,3±0,6 | 0,4±0,7 | <0,001 |
| 4 | 2,0±0,8 | 0,2±0,4 | 0,1±0,3 | 0,6±1,0 | <0,001 |
| Межгрупповое различие Significance between groups |
p=0,406 | p=0,028 | p=0,009 | p=0,56 |
р* Значимость изменения со временем, до лечения vs. 3 сутки;
р* Significance of change within time, before treatment vs. 3 days
ОБСУЖДЕНИЕ
«Цисталис® Д Плюс» достоверно уменьшает степень микробного обсеменения мочи, по результатам как микроскопии осадка мочи, так и бактериологического исследования. Это логичное следствие специфического действия D-маннозы на основного возбудителя цистита – кишечную палочку.
Недавний метаанализ, опубликованный в Кокрановской библиотеке, показал, что в настоящее время из-за выраженной гетерогенности исследований (различные дозировки, группы сравнения, длительность применения и т.д.) нет возможности сделать обоснованный вывод об эффективности либо неэффективности D-маннозы в лечении инфекций мочевыводящих путей [10]. На 2023 г. существует лишь ограниченное число рандомизированных сравнительных исследований показавших, что D-манноза в монотерапии имеет преимущества перед плацебо или антибактериальной терапией.
Рандомизированное исследование в сравнении с продолжительной профилактикой нитрофурантоином показало, что применение D-маннозы в течение 6 месяцев снижает вероятность развития рецидива с 60% до 15% по сравнению с группой, не получавшей какой-либо профилактики. Эффективность D-маннозы в профилактике обострений цистита оказалась сходной с нитрофурантоином [11].
В другом исследовании при сравнении с интермиттирующей антибиотикопрофилактикой (ко-тримоксазол 600 мг на ночь 1 неделя в месяц) применение D-маннозы показало достоверно более высокую эффективность в продлении периода ремиссии (52,7±11,2 дней для ко-тримоксазола против 200±50,7 дней для D-маннозы [12].
По результатам другого исследования даже кратковременное применение D-маннозы в течение 2 недель достоверно снижает с 33,3% до 4,5% частоту рецидивирования при наблюдении в течение 12 месяцев [13].
Высокая эффективность «Цисталиса® Д Плюс» может быть обусловлена тем, что в нем содержится не только Д-манноза, но и проантоцианидины. Как было показано ранее в исследованиях, добавление 2 г D-маннозы к проантицианидинам позволяет еще на 44,4% уменьшить частоту возникновения рецидивов по сравнению с теми, кто принимает только проантоцианидины [14].
«Цисталис® Д Плюс» в монотерапии достоверно снижает выраженность воспалительных изменений, сохраняя противовоспалительный эффект даже через 30 дней. Уровень лейкоцитов в моче снижается в 5,5 раз. Группы, помимо «Цисталиса® Д Плюс» принимавшие НПВС, феназопиридин или фосфомицина трометамол, показали более выраженное снижение воспалительных маркеров в моче, что является вполне очевидным исходом. Любопытно, что на 30 сутки после лечения, достоверная разница между группами исчезает.
Возможно, выраженная противовоспалительная активность «Цисталиса® Д Плюс» связана с наличием высокой дозировки олигомерных проантоцианидинов (OPC). Поскольку OPC показали способность снижать образование множества провоспалительных цитокинов (TNF-α, Il-1β) и уменьшать выработку перекиси водорода макрофагами [15,16].
В ходе исследования мы показали, что «Цисталис® Д Плюс», как в режиме монотерапии, так и в сочетании с НПВС и анальгетиками, уже на 3 сутки более чем в два раза уменьшает интенсивность боли. После 7 суток лечения выраженность боли была сопоставима во всех группах.
«Цисталис® Д Плюс» в режиме монотерапии быстро и достоверно снижает выраженность симптомов цистита (-63,9% на 3 сутки по шкале ACSS). «Цисталис® Д Плюс» при приеме в начале заболевания имеет сопоставимую эффективность в снижении симптомов острого цистита, по сравнению с комплексной терапией, включающей НПВС или феназопиридин при оценке на 3, 7 и 30 сутки.
Бактериостатическая активность в отношении патогенов, отличных от E.coli, может объясняться присутствием в «Цисталис® Д Плюс» арбутина – более универсального антибактериального агента, который уже много лет успешно применяется в лечении ИМП. Арбутин по своей сути является пролекарством, которое в организме превращается в гидрохинон, который на 90,7% выделяется с мочой [17]. Данное вещество оказывает прямой бактерицидный эффект в отношении более чем 70 видов бактерий. В зависимости от концентрации гидрохинон приводит либо к высвобождению составляющих клетки (нуклеиновые кислоты, глутаминовая кислота) во внешнюю среду, либо к денатурации бактериальных белков и лизису клеточной мембраны, либо к агглютинации бактерий [18].
В рандомизированных сравнительных исследованиях было показано, что применение аскорбиновой кислоты в 2,3 раза снижало риск рецидива ИМП у беременных женщин [19]. Лечебное воздействие аскорбиновой кислоты в этой ситуации реализуется за счет уменьшения экспрессии генов, отвечающих за антибиотикорезистентность (blaSHV, blaTEM, blaCTX-M, blaVIM, blaNDM, и blaIMP) и формирование биопленок (lasR, lecA и pelA), а также антиоксидантной активности [20].
Несмотря на выраженный клинический и противорецидивный эффект, в группах, не получавших антибиотик, не у всех пациентов удалось достигнуть стерильности мочи. Тем не менее, у 94,5% из таких пациентов степень микробной нагрузки опустилась ниже диагностически значимого титра в 105 КОЕ/мл в группе 1 и у 77,8% – в группе 2. Таким образом, если принять в расчет тех пациентов, у которых была отмечена полная элиминация возбудителя, то общая микробиологическая эффективность лечения составила: 96,3%; 86,7%; 100%, 100%, в группах 1, 2, 3 и 4, соответственно.
ЗАКЛЮЧЕНИЕ
«Цисталис® Д Плюс», как в режиме монотерапии, так и в сочетании с другими группами препаратов, достоверно приводит к быстрому и стойкому облегчению симптомов рецидивирующего цистита (уменьшение боли, снижение частоты мочеиспускания), а также к выраженному снижению микробной нагрузки у пациенток с рецидивирующим циститом.
ЛИТЕРАТУРА
- Foxman B. Urinary tract infection syndromes: occurrence, recurrence, bacteriology, risk factors, and disease burden. Infect Dis Clin North Am 2014;28(1):1-13. https://doi.org/10.1016/j.idc.2013.09.003.
- Слесаревская М.Н., Игнашов Ю.А., Кузьмин И.В., Аль-Шукри С.Х. Стойкая дизурия у женщин: этиологическая диагностика и лечение. Урологические ведомости 2021;11(3):195-204. [Slesarevskaya M.N., Ignashov Y.A., Kuzmin I.V., Al-Shukri S.K. Persistent dysuria in women: etiological diagnostics and treatment. Urologicheskie vedomosti = Urology reports 2021;11(3):195-204. (In Russian)]. https://doi.org/10.17816/uroved81948.
- Борисов В.В. Диагностика и терапия инфекций мочевыводящих путей. О чем следует помнить всегда (клиническая лекция). Часть 1. Урологические ведомости 2017;7(3):52–9. [Borisov V.V. Diagnosis and therapy of urinary tract infections. What should always be remembered (clinical lecture). Part 1. Urologicheskie vedomosti = Urology reports 2017;7(3):52–9. https://doi.org/10.17816/uroved7352-59. (In Russian)].
- Gupta K, Trautner BW. Diagnosis and management of recurrent urinary tract infections in non-pregnant women. BMJ 2013;346:f3140. https://doi.org/10.1136/bmj.f3140.
- Перепанова Т.С., Козлов Р.С., Руднов В.А., Синякова Л.А., Палагин И.С. Антимикробная терапия и профилактика инфекций почек, мочевыводящих путей и мужских половых органов. Федеральные клинические рекомендации 2022;126 с. [Perepanova T.S., Kozlov R.S., Rudnov V.A., Sinyakova L.A., Palagin I.S. Antimicrobial therapy and prevention of infections of the kidneys, urinary tract and male genital organs. Federal clinical guidelines 2022;126 p. (In Russian)].
- Sarshar M, Behzadi P, Ambrosi C, Zagaglia C, Palamara AT, Scribano D. FimH and Anti-Adhesive therapeutics: A disarming strategy against uropathogens. Antibiotics (Basel) 2020;9(7):397. https://doi.org/10.3390/antibiotics9070397.
- Sharma V, Ichikawa M, Freeze HH. Mannose metabolism: More than meets the eye. Biochem Biophys Res Commun 2014;453:220–8. https://doi.org/10.1016/j.bbrc.2014.06.021.
- Hu X, Shi Y, Zhang P, Miao M, Zhang T, Jiang B. D-Mannose: Properties, production, and applications: An overview. Compr Rev Food Sci Food Saf 2016;15:773–85. https://doi.org/10.1111/1541-4337.12211.
- Alidjanov JF, Abdufattaev UA, Makhsudov SA, Pilatz A, Akilov FA, Naber KG, Wagenlehner FM. New self-reporting questionnaire to assess urinary tract infections and differential diagnosis: acute cystitis symptom score. Urol Int 2014;92(2):230-6. https://doi.org/10.1159/000356177.
- Cooper TE, Teng C, Howell M, Teixeira-Pinto A, Jaure A, Wong G. D-mannose for preventing and treating urinary tract infections. Cochrane Database Syst Rev 2022;8(8):CD013608. https://doi.org/10.1002/14651858.CD013608.pub2.
- Kranjčec B, Papeš D, Altarac S. D-mannose powder for prophylaxis of recurrent urinary tract infections in women: A randomized clinical trial. World J Urol 2014;32(1):79–84. https://doi.org/10.1007/s00345-013-1091-6.
- Porru D, Parmigiani A, Tinelli C, Barletta D, Choussos D, Di Franco C, et al. Oral D-mannose in recurrent urinary tract infections in women: A pilot study. J Clin Urol 2014;7(3):208–13. https://doi.org/10.1177/2051415813518332.
- Domenici L, Monti M, Bracchi C, Giorgini M, Colagiovanni V, Muzii L, Benedetti Panici P. D-mannose: a promising support for acute urinary tract infections in women. A pilot study. Eur Rev Med Pharmacol Sci 2016;20(13):2920-5.
- Salinas-Casado J, Méndez-Rubio S, Esteban-Fuertes M, Gómez-Rodríguez A, Vírseda-Chamorro M, Luján-Galán M, Iglesias-García C, Rituman G. Large study (283 women) on the effectiveness of Manosar®: 2 g of d-mannose + 140 mg of proanthocyanidins (PAC), of prolonged release. Arch Esp Urol 2020;73(6):491-8.
- Li WG, Zhang XY, Wu YJ, Tian X. Anti-inflammatory effect and mechanism of proanthocyanidins from grape seeds. Acta Pharmacol Sin 2001;22(12):1117-20.
- Bayeta E, Lau BHS. Pycnogenol inhibits generation of inflammatory mediators in macrophages. Nutr Res 2000;20(2):249–59. https://doi.org/10.1016/S0271-5317(99)00157-8.
- Quintus J, Kovar KA, Link P, Hamacher H. Urinary excretion of arbutin metabolites after oral administration of bearberry leaf extracts. Planta Med 2005;71(2):147–52. https://doi.org/10.1055/s-2005-837782.
- Maris P. Modes of action of disinfectants. Rev Sci Tech 1995;14(1):47-55. https://doi.org/10.20506/rst.14.1.829.
- Ochoa-Brust GJ, Fernández AR, Villanueva-Ruiz GJ, Velasco R, Trujillo-Hernández B, Vásquez C. Daily intake of 100 mg ascorbic acid as urinary tract infection prophylactic agent during pregnancy. Acta Obstet Gynecol Scand 2007;86(7):783-7. https://doi.org/10.1080/00016340701273189.
- Hassuna NA, Rabie EM, Mahd WKM. Refaie MMM, Yousef RKM, Abdelraheem WM. Antibacterial effect of vitamin C against uropathogenic E. coli in vitro and in vivo. BMC Microbiol 2023;23:112. https://doi.org/10.1186/s12866-023-02856-3.







