Интерстициальный цистит/синдром болезненного мочевого пузыря (ИЦ/СБМП), является хроническим заболеванием, проявляющимся болевым синдромом, увеличением частоты мочеиспускания и наличиемчастых эпизодов ургентности.Это состояние трудно диагностировать, причем ряд исследователей описывает 2 отдельных расстройства: «интерстициальный цистит» как хроническое воспалительное заболевание и «синдром болезненного мочевого пузыря», в котором часто отсутствует воспалительный компонент [1-3]. Помнению Я.Б. Миркина и соавт. причиной развития ИЦ является повреждение гликозаминогликанового слоя уротелия, затемв процесс включаются другие патогенетические звенья: ЦНС, органыимышцымалого таза [4].ПриСБМПпервичной причинойможет быть не поражение уротелия, а нейрогенная дисфункция или хроническая ишемия мочевого пузыря.
Тем не менее, общая этиология и патофизология ИЦ/ СБМП остается неясной и может включать в себя как инфекционные, неврологические, аллергические, аутоиммунные факторы, так и токсические вещества мочи [5]. В целях лучшего понимания патофизиологии ИЦ/ СБМП созданыразличные экспериментальные модели хронического цистита [6,7]. Однако они имеют определенные недостатки. Например, эффекты внутрипузырной инстилляции раздражителя или иммуностимулятора, которые были исследованы у ряда животных (морских свинок, грызунов, кроликов и кошек), демонстрируют значительную изменчивость [8]. Однако большинство моделей, предложенных различными авторами эффективны [9,10]. В настоящее время актуально изучение диагностической и терапевтической значимости биомаркеров ИЦ/СХТБ в частности, фактор роста нервов (NGF).
Результаты ряда исследований выявили его связь с гиперактивным мочевым пузыреми ИЦ/СБМП, чтоможет помочь в дифференциальной диагностике этих состояний [11-14]. Известно, что в мочевом пузыре фактор роста нервов экспрессируется в клетках уротелия и гладких мышцах [15]. Сообщается, что на модели трансгенных мышей высокая степень выраженности NGF в мочевом пузыре способствовала изменениям функции мочевого пузыря [16], а также возникновению интерстициального цистита [15]. Тем не менее, роль фактора роста нервов в развитии ИЦ/СБМП, остается не ясной, а данные литературы по этому вопросу порой, противоречивы. В связи с этим, исследование уровня фактора роста в крови и моче при ИЦ/ СБМП, как диагностического биомаркера является необходимым.
Цель исследования – оценить уровень фактора роста нервов в крови и моче в различных экспериментальных моделях интерстициального цистита/синдрома болезненного мочевого пузыря для выявления оптимальной модели цистита.
Таблица 1. Группы кроликов с моделированным ИЦ/СБМП
Table 1. Groups of rabbits with simulated IC / BPS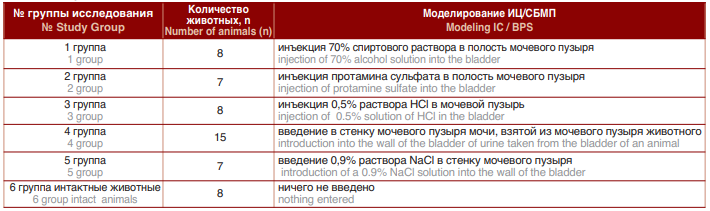
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Моделирование ИЦ/СБМП проведено на белых новозеландских кроликах-самках массой 1500-2000 г. При содержании животных и проведении экспериментальных исследований соблюдали правила по уходу и использования лабораторных животных (NIH Guide for the Care and Use of Laboratory Animals) и их соблюдением [17]. Моделирование ИЦ/СБМП на кроликах было создано несколькими путями, в связи с чем животных разделили на 6 групп (табл.1). Животных подвергали воздействию 70% раствора спирта, протамина сульфата, соляной кислоты (HCl), мочи, физ. раствора (NaCl). У животных I, II и III группы ИЦ/СБМП был вызван внутрипузырной инстилляцией 70% спиртовым раствором, протамин сульфат (10 мг) и HCl (0,2 мл 0,5% HCl), соответственно. У животных IV группы ИЦ/СБМП модель создана на основе одной этиологических теорий ИЦ, согласно которой к поражению гликозаминогликанового слоя приводят агрессивные свойства мочи [18]. Кроликам был сделан надлобковый разрез, после чего взятая из мочевого пузыря моча шприцем с иглой 30- го калибра в объеме 0,5см3 введена под слизистую оболочку слой мочевого пузыря.
Животным V группы в стенку мочевого пузыря вводили 1 мл NaCl. Фактор роста нервов определяли твердофазным иммуноферментным методом (ELISA) с помощью набора NGF Emax®. Концентрацию NGF определяли в крови и моче. Измерения проводили через 1 и 14 дней после создания экспериментальной модели. Статистическая обработка полученных данных проведена с помощью программ «Statistica forWindows 8.0» и «Microso Excel». Рассчитаны сл. показатели: среднее значение (average), стандартное отклонение среднего (Standard Deviation). Различия считали достоверными при значении p<0,05.Корреляционную зависимость между показателями в крови и моче рассчитывали по коэффициенту корреляции Пирсона.
РЕЗУЛЬТАТЫ ИСЛЕДОВАНИЯ
Результаты исследования уровня фактора роста нервов в экспериментальных группах представлены в таблице 2.
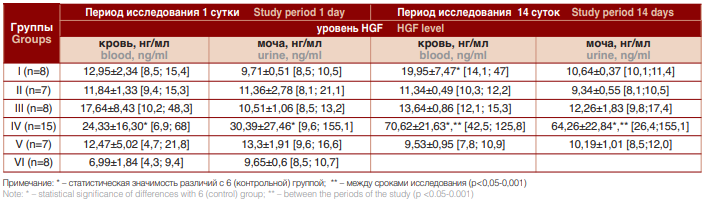
Таблица 2. Уровень фактора роста нервов в крови и моче в группах обследования в течение эксперимента
Table 2. The level of nerve growth factor in blood and urine in the examination groups during the experiment)
Анализ концентрации фактора роста нервов в первый день исследования выявил статистически значимое повышение уровня биомаркера в крови во всех группах по сравнению с контрольной. Так, в Iгруппе уровень NGF превышал контрольный на 46,0% (р<0,05), во II группе – на 41,0% (р<0,05), в III группе – на 60,4% (р<0,01), в IV и V группах – на 71,3 (p<0,01) и 44,0% (р<0,05). Наиболее высокий уровень повышения уровеня NGF наблюдался в IV группе животных. В этот же срок обследования уровень NGF в моче лишь в IV группе статистически значимо превышал контрольный (на 68,2%, р<0,01), в других группах различие было незначительным.Спустя 14 дней сохранялся повышенный уровень NGF в крови во всех группах по отношению к контрольной группе (р<0,05), но особенно выраженная разница отмечалась в IV группе – 90,1% (р<0,001). Концентрация NGF в моче во всех группах была выше контрольной, но статистически значимое различие наблюдалось в IV группе – 85,0% (р<0,001). Обращала на себя внимание широкая вариабельность значений NGF в крови в первые сутки у кроликов III, IV и V групп, а в моче – в IV группе. Спустя 14 суток значительная вариабельность значений наблюдалась в крови животных I и IV групп, в моче – лишь в IV группе.
При внутригрупповом анализе уровня NGF в каждой из экспериментальных групп выявлялась следующая тенденция:
- в I группе наблюдения отмечалась тенденция к увеличению уровня NGF в различные сроки, причем как в крови, так и в моче. Через 14 дней после создания модели в этой группе по сравнению с начальным значением отмечалось повышение содержания NGF в крови на 35,1% (p<0,05), в моче – на 8,7%.
- во IIгруппе на 14 сутки исследования отмечалось незначительное снижение уровня фактора роста нервов.
- в IIIгруппе концентрация NGF в крови уменьшилась на 29,3%, тогда как в моче увеличилась на 14,3%.
- в IV группе спустя 14 суток по сравнению с первым днем после введения мочи определялось существенное возрастание уровня NGF в крови и моче, соответственно на 65,5% (p<0,01) и 52,7% (p<0,05).
- в V группе отмечалось снижение концентрации NGF в крови и моче, разница с начальным сроком наблюдения в крови составила 30,8%, в моче – 30,5%.
При определении коэффициента корреляции между величинами NGF в крови и моче выявленыразнонаправленные связи (табл. 3).Сильная положительная, статистически значимая корреляция отмечалась во IIгруппе на 14 день исследования. В контрольной группе отмечалась слабая положительная связь между величинами NGF в крови и моче.
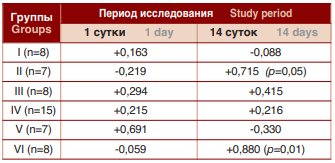
Таблица 3. Коэффициент корреляции между показателями фактора роста нервов в крови и моче
Table 3. Correlation coefficient between indicators of nerve growth factor in blood and urine
Следовательно, более выраженные изменения уровня NGF в крови и моче по сравнению с контрольной группой отмечаются вмодели ИЦ/СБМП с введениемв стенкумочевого пузыря мочи. Уровни NGF в крови у животных II группы коррелировали с уровнями NGF в моче. Сопоставление показателей контрольной группы с I, II, III и V группами выявило статистически значимые изменения в крови и их отсутствие в моче. При этом уровень NGF у животных с моделью ИЦ/СБМП на основе введения мочи в стенку мочевого пузыря статистически значимо отличался от показателей других вариантов моделей, а также с контактной группой. Динамическое исследование показало статистически значимые изменения концентрации NGF у животных в моделях с введением мочи в стенку мочевого пузыря.
ОБСУЖДЕНИЕ
Нами рассмотрены 5 вариантов экспериментальных моделей ИЦ/СБМП, из которых 3 (I, II, III группы) – химические модели, 1 модель – введение мочи в стенку пузыря (IV группа), 1 модель с введением физ. раствора и группа с интактными кроликами.У животных всех групп исследован уровень фактора роста нервов спустя 1 и 14 дней. Известно, что этиология ИЦ/СБМП включает воспалительные, аутоиммунные, нейротоксичные и сосудистые компоненты. Помимо этого, исчезновение гликозаминогликанового слоя из поверхностного уротелия и мочевая токсичность были предложены в качестве патофизиологических механизмов [18].
Проведенное нами исследование выявило статистически значимое повышение концентрации исследуемого NGF в крови у животных всех экспериментальных вариантов, но особенно высокий уровень определялся в группе с введением мочи в подслизистую мочевого пузыря, причем, как в крови, так и в моче. Полученные нами результаты сопоставимы с данными ряда исследователей [15]. Имеются также сообщения о повышенном уровне NGF в воспаленной ткани мочевого пузыря в моделях ИЦ на крысах [13,14]. Многие исследователи считают NGF потенциальным биомаркером ИЦ/СБМП. Установлено, что уровень NGF в моче может служить биомаркером для диагностики ИЦ/ СБМП, биомаркером в моче для дифференциальной диагностики этого заболевания и гиперактивного мочевого пузыря, а также является прогностическим фактором [13].
Следует отметить, что после сообщений, о том, что воспаление увеличивает экспрессию NGF, интерес к нему возрос, как важному показателю воспаления ИЦ/СБМП. Фундаментальные исследования показали, что воспаление вызывает нейропластичность, которая приводит к повышению уровня NGF вмочевомпузыре и генерирует ИЦ/СБМП [13]. Ряд авторов считает, что NGF играет важную роль в патогенезе ИЦ/СБМП [12,13]. Мы исследовали уровень NGF в динамике. Сравнительный анализ показал, что через 14 суток уровень NGF статистически значимо повышается в группе животных с моделью, созданной введением мочи в стенку мочевого пузыря. Заметная тесная корреляция (р=0,05) выявлялась у животных с моделью, созданной инъекцией протамина сульфата. Наличие повышенного уровня NGF в крови и моче при ИЦ/СБМП, по-видимому, вызвано воспалительными компонентами, а выраженное повышение уровня NGF у животных с созданноймоделью введениеммочи в стенкумочевого пузыря обусловлено токсичностью компонентов мочи и развитием хронического воспаления.
ВЫВОДЫ
- Укроликов смоделированием ИЦ/СБМП путемвведения 70% раствора спирта, протамин сульфата, HCl, NaCl и введениямочи в подслизистую оболочкумочевого пузыря отмечаются статистически значимо высокие уровни фактора роста нервов в крови.
- Среди часто используемых экспериментальных моделей ИЦ/СБМП наиболее стабильной моделью, обеспечивающей длительный эффект, является введение мочи в стенку мочевого пузыря.
ЛИТЕРАТУРА
- Birder L, Andersson K-E. Animal Modelling of Interstitial Cystitis/Bladder Pain Syndrome. Int Neurourol J 2018;22(Suppl 1):S3-9. doi: 10.5213/inj.1835062.531.
- Kwon W-A. Animal Model of Interstitial Cystitis/Bladder Pain Syndrome. Int Neurourol J 2018; 22 (Suppl 1): S1-2. doi: 10.5213/inj.1820edi.001.
- Schrepf A, O’Donnell M, Luo Y, Bradley CS, Kreder K, Lutgendorf S. Inflammation and inflammatory control ininterstitial cystitis/bladder pain syndrome: Associations with painful symptoms. PAIN 2014;155(9): 1755–1761. doi: 10.1016/j.pain.2014.05.029.
- Миркин Я.Б.,КарапетянА.В., ШумовС.Ю. Интерстициальный цистит: дискуссия о патогенезе, диагностике и лечении.Часть 1 – патогенез. Экспериментальная и клиническая урология 2017;(4):96-100. [MirkinYa.B.,KarapetyanA.V., Shumov S.Yu. Interstitial cystitis – pathogenesis, diagnosis and treatment strategies: an update. Рart 1 – pathogenesis. Eksperimental'naya i klinicheskaya urologiya=Experimental and clinical urology 2017;(4):96-100. (In Russian)].
- Зайцев А.В., Пушкарь Д.Ю., Корсунская И.Л., Ковылина М.В., Цыбуля О.А. Современные аспекты диагностики и лечения синдрома болезненного мочевого пузыря/интерстициального цистита. Русский медицинский журнал 2010;18(17):1084-1089.[ZaitsevA.V., Pushkar D.Yu.,Korsunskaya I.L.,Kovylina M.V., Tsybula O.A. Modern aspects of the diagnosis and treatment of bladder pain syndrome / interstitial cystitis. Russkiy meditsinskiy zhurnal = Russian medical journal 2010;18(17):1084-1089 (In Russian)].
- Jhang JF, Kuo HC. Pathomechanism of interstitial cystitis/bladder pain syndrome and mapping the heterogeneity of disease. Int Neurourol J 2016; 20(Suppl 2): S95–104. doi: 10.5213/inj.1632712.356
- Bayrak O, Erturhan S, Seckiner I, Erbagci A, Ustun A, Karakok M. Chemical cystitis developed in experimental animals model:Topical effect of intravesical ozone application to bladder. UrolAnn 2014;6:122- 6. doi: 10.4103/0974-7796.130553
- Song PH, Chun SY, Chung JW, Kim YY, Lee HJ, Lee JN, et al. Comparison of 5 different rat models to establish a standard animal model for research into interstitial cystitis. Int Neurourol J 2017;21(3):163- 170. doi: https://doi.org/10.5213/inj.1734898.449
- Homma Y, Ueda T, Tomoe H, LinAT, Kuo HC, Lee MH, et al. Clinical guidelinesforinterstitial cystitis and hypersensitive bladder updated in 2015. Int J Urol 2016; 23(7): 542–549. doi: 10.1111/iju.13118
- Liu HT, Jiang YH, Kuo HC. Alteration of urothelial Inflammation, apoptosis, and junction protein in patients with various bladder conditions and storage bladder symptoms suggest common pathway involved in underlying pathophysiology. Low Urin Tract Symptoms 2015;7(2):102-107. doi: 10.1111/luts.12062
- ChenW,Ye DY, Han DJ, Fu GQ, ZengX, LinW, LiangY. Elevated level of nerve growth factorin the bladder pain syndrome/interstitial cystitis: a meta-analysis. Springer plus 2016;5(1):1072. doi: 10.1186/s40064-016-2719-y.
- Chang D, Hsu E, Hottinger D, Cohen SP. Anti-nerve growth factor in pain management: current evidence. J Pain Res 2016;9:373-383. doi: 10.2147/JPR.S89061
- Qu H-C, Zhang W, Yan S, Liu Y-L, Wang P. Urinary nerve growth factor could be a biomarker for interstitialCystitis/Painful Bladder Syndrome: a meta-analysis. PLoS One 2014; 9(9):e106321. doi: 10.1371/ journal.pone.0106321
- Liu H-T,Kuo H-C. Biomarkersfor patientswith interstitial cystitis/bladder pain syndrome. Urological Science 2015; 26(4): 225-229. doi:10.1016/j.urols.2015.02.002
- Steers WD, Tuttle JB. Mechanisms of disease: the role of nerve growth factor in the pathophysiology of bladder disorders. Nat Clin Pract Urol 2006;3(2):101-110. doi:10.1038/ncpuro0408
- Schnegelsberg B, Sun TT, Cain G, Bhattacharya A, Nunn PA, Ford AP. et al. Overexpression of NGF in mouse urothelium leadsto neuronal hyperinnervation, pelvic sensitivity, and changesin urinary bladder function.Am J Physiol RegulIntegr Comp Physiol 2010; 298: R534-R547. doi: 10.1152/ajpregu.00367.2009
- Руководство по содержанию и использованию лабораторных животных. Пер. с англ. под ред. И.В. Белозерцевой, Д.В. Блинова, М.С. Красильщиковой. Москва: ИРБИС, 2017:336 с. [Guidelines forthe maintenance and use of laboratory animals.Trans. from English underthe editors I.V. Belozertseva, D.V. Blinova, M.S. M.: IRBIS, 2017:336 p].
- Sand PK. Proposed pathogenesis of painful bladder syndrome/interstitial cystitis. J Reprod Med 2006;51(3 Suppl):234-240.







