ВВЕДЕНИЕ
Беременные с патологией органов мочевыделительной системы относятся к группе высокого риска таких осложнений гестации, как преэклампсия, задержка роста плода, анемия, невынашивание, внутриамниотическая инфекция, перинатальная заболеваемость и смертность [1, 2]. Хотя не доказано, что эти ассоциации являются причинно-следственными, большинство осложнений, по-видимому, связано с повреждением почек, вызванным бактериальными эндотоксинами и системным воспалительным ответом с повреждением эндотелия сосудов.
Механизмы, лежащие в основе наблюдаемых ассоциаций, неясны, и вполне вероятно, что некоторые неблагоприятные исходы беременности являются результатом предрасположенности к хроническим заболеваниям [3]. Патология мочевыделительной системы является тем неблагоприятным фоном, на котором быстро истощаются возможности гестационных адаптационных механизмов и развиваются многочисленные осложнения беременности. Однако сравнительно мало известно о риске развития послеродовой инфекции у беременных с заболеваниями органов мочевыделительной системы.
Введение рутинного скрининга на бессимптомную бактериурию (ББУ) и алгоритмов ее лечения у беременных позволило лишь незначительно уменьшить частоту пиелонефритов в этой категории пациентов. Вероятно, это обусловлено ростом уровня антибиотикорезистентности уропатогенов, что требует изменения подхода к антимикробной терапии. Данные о результатах лечения ББУ получены в основном более 40 лет назад и требуют современной верификации [4, 6]. Протективные свойства некоторых компонентов уробиома [5, 7], а также результаты исследования NTR3068 [8] подвергают сомнению текущие подходы к тактике лечения ББУ у беременных. В указанной работе при достаточно большой выборке наблюдений (5621 человек) у пациенток без ББУ было зарегистрировано 16 случаев эндометрита против 0 случаев у пациенток с ББУ, причем как получавших антибактериальную терапию, так и входивших в группу плацебо.
Кроме того, на сегодняшний день остается открытым вопрос: следует ли беременным, у которых ББУ не была выявлена при первом обследовании, проходить дополнительный скрининг на более поздних сроках беременности? Отдельно следует отметить, что специальных алгоритмов для лечения ББУ у беременных нет ни в отечественных, ни в западных клинических рекомендациях; предлагается лишь выбрать антибактериальный препарат с учетом антибиотикограммы и данных о безопасности, а также длительность его применения.
ББУ у небеременных женщин, как правило, не связана с повышенным риском симптоматических инфекций мочевыводящих путей. Во время беременности прогестерон-индуцированное изменение уродинамики приводит к застою мочи и увеличивает вероятность восходящего инфицирования и развития пиелонефрита. В настоящее время также хорошо изучена связь симптомной и бессимптомной инфекции мочевых путей с осложнениями гестации (преждевременные роды, анемия, преэклампсия и гипотрофия плода) [9-11]. Кроме того, пиелонефрит является ведущей причиной септического шока во время беременности [12-14]. Однако вопрос коморбидности патологии органов мочевыделительной системы и послеродовых инфекционно-воспалительных осложнений по-прежнему остается мало освещенным.
В национальных клинических рекомендациях к наиболее значимым факторам риска послеродовых септических осложнений относят: возраст <20 и ≥40 лет, кесарево сечение (КС), большой паритет родов и мертворождение [15]. Отягощенному соматическому фону и, в частности, патологии органов мочевыделительной системы не уделено должного внимания. Признается актуальным поиск наиболее информативных предикторов риска развития послеродовой инфекции на фоне хронических соматических заболеваний, выявление которых на этапе беременности следует относить к вопросам предиктивной диагностики. Имеются единичные работы, подчеркивающие ассоциацию послеродовых инфекционно-воспалительных осложнений с инфекцией мочевых путей, которые, несомненно, вносят вклад в риск реализации послеродовой инфекции и тяжесть ее течения [16, 17]. Настоящее исследование направлено на изучение послеродовой (послеоперационной) инфекции, путем анализа информативности ее предикторов у пациенток с отягощенным соматическим анамнезом для последующего формирования рекомендаций по клинической диагностике, лечению и профилактике.
Цель исследования – оценить распространенность и структуру заболеваний органов мочевыделительной системы у родильниц с эндометритом после кесарева сечения, определить их прогностическое значение как независимых предикторов развития послеоперационных инфекционно-воспалительных осложнений.
МАТЕРИАЛЫ И МЕТОДЫ
Проведен ретроспективный многоцентровой статистический анализ историй болезни и данных первичной медицинской документации 648 родильниц, родоразрешенных путем операции КС, из них 406 – с диагнозом «эндометрит после кесарева сечения» (основная группа) и 242 – с физиологическим течением послеоперационного периода (контрольная группа).
Критерии включения в исследование для основной группы: стандартное эпидемиологическое определение случая – эндометрит после КС [15]. Критерии исключения: отсутствие возможности дополнительной экспертизы первичной медицинской документации (копий, выписок), историй болезни, амбулаторной и обменной карт.
Обследование на наличие инфекции мочевыводящих путей проведено в соответствии с клиническими рекомендациями «Инфекция мочевых путей при беременности» (2022) [1]. ББУ диагностировали как бактериальную мочевую инфекцию без каких-либо типичных симптомов, связанных с воспалением мочевыводящих путей. Диагноз ББУ подтверждали при культуральном исследовании двух последовательных средних порций мочи (с разницей не более 2 нед. и не менее 24 ч.) и обнаружения одного и того же уропатогена в диагностически значимом количестве ≥105 КОЕ/мл, вне зависимости от наличия или отсутствия лейкоцитурии. В случае забора пробы мочи уретральным катетером диагностическим титром считали 102 КОЕ/мл. При симптомной инфекции мочевых путей контрольное микробиологическое исследование мочи не выполнялось. Для беременных с пиелонефритом минимальным диагностическим критерием считали бактериурию 103 КОЕ/мл. Диагноз цистита у беременных устанавливали на основании симптомов (мутная моча, дизурия, частые императивные позывы, боли в животе или надлобковой области) и наличия в моче даже небольшого количества бактериальных колоний (≥102 КОЕ/мл).
В ряде случаев при наличии показаний со стороны сопутствующей экстрагенитальной патологии применяли дополнительные клинико-лабораторные и инструментальные методы исследования (оценка скорости клубочковой фильтрации с помощью пробы Реберга, расширенный биохимический анализ крови, анализ мочи по Нечипоренко, регистрация ЭКГ, консультации смежных специалистов). Информацию о коморбидном статусе получали путем ретроспективного анализа данных из различных форм первичной медицинской документации, выписных эпикризов, изучения результатов клинико-лабораторного обследования и консультаций профильных специалистов.
Статистическую обработку полученных данных выполняли с помощью пакета программ STATISTICA for Windows 10,0. Методы описательной статистики включали расчет частот наблюдаемых признаков в группах пациенток, анализ межгрупповых различий по этим показателям проводили с использованием критерия хи-квадрат.
Также был проведен многофакторный логистический регрессионный анализ с расчетом отношения шансов (ОШ) развития эндометрита у пациенток, включенных в исследование в соответствующих группах (с наличием и в отсутствие проверяемого признака) с 95% доверительным интервалом (ДИ). Критический уровень достоверности нулевой статистической гипотезы принимали равным 0,05.
РЕЗУЛЬТАТЫ
При оценке соматического статуса пациенток, включенных в исследование, обращает внимание наличие у родильниц с эндометритом высокой частоты выявленных первичных и вторичных экстрагенитальных заболеваний (52,7%, 214/406 и 54,9%, 223/406, соответственно). Количество здоровых родильниц (без отягощенного преморбидного фона) в основной группе достоверно меньше, чем в группе контроля (18,7%, 76/406 и 62,4%, 151/242, соответственно, χ2=127,1; p<0,001).
В структуре основной экстрагенитальной патологии у родильниц с эндометритом заболевания мочевыделительной системы занимают 3-е место (рис. 1) и встречаются достоверно чаще, чем у родильниц контрольной группы (56,5%, 229/406 и 24,4% 59/242 соответственно, χ2 =62,98; p<0,001).
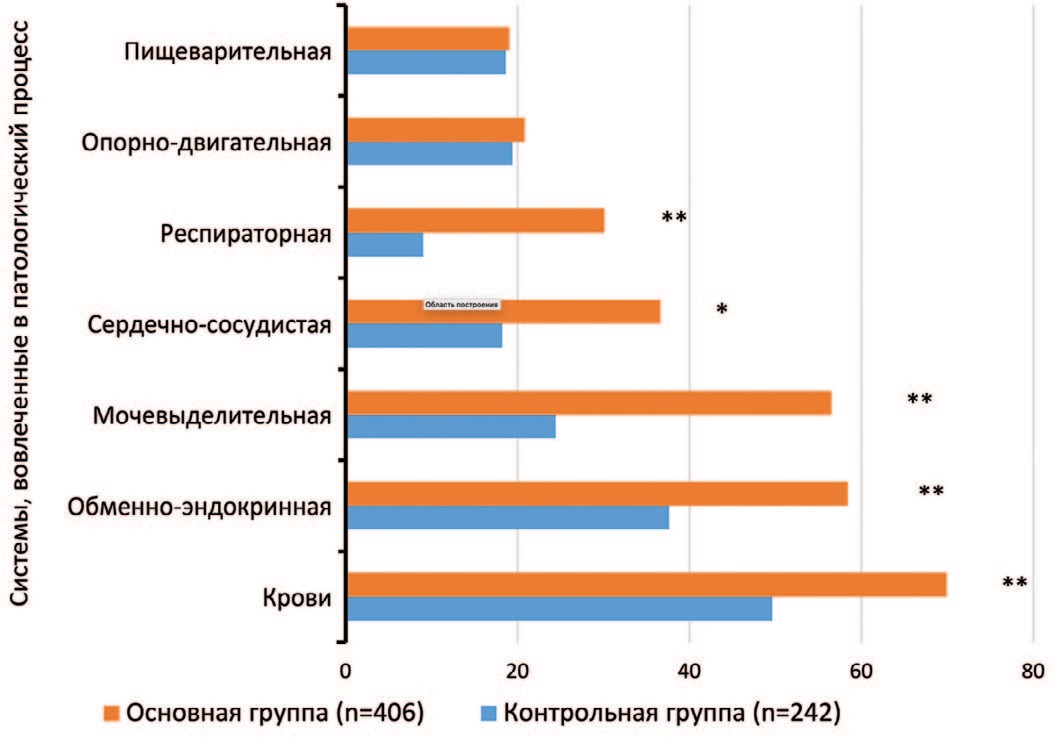
Рис. 1. Структура и частота вовлеченных систем организма у родильниц с эндометритом после кесарева сечения (n=648), %
Примечание: * р<0,05; ** p<0,001
Fig. 1. Structure and frequency of involved body systems in postpartum women with endometritis after cesarean section (n=648), %
Note: * p<0.05; **p<0.001
Лидирующую позицию в сопутствующей патологии органов мочевыделительной системы у родильниц с эндометритом занимали осложненные и неосложненные инфекции мочевыводящих путей, диагностированные достоверно чаще, чем в группе контроля (42,6%, 173/406 и 17,4% 42/242 соответственно, χ2=43,622; p<0,001) (табл. 1). В выборке не было выявлено пациенток с выраженным снижением функции почек: скорость клубочковой фильтрации составляла более 60 мл/мин/1,73 м2. В обеих группах не было выявлено пациенток, получавших заместительную почечную терапию (в т.ч. после аллотрансплантации почки), а также с вторичным поражением почек на фоне системных заболеваний. За оцениваемый период наблюдения ни одна пациентка не перенесла острое почечное повреждение любой этиологии.
Таблица 1. Заболевания органов мочевыделительной системы у обследованных родильниц, абс. (%)
Table 1. Diseases of the urinary system in the examined puerperas, abs. (%)
| Заболевания органов мочевыделительной системы Diseases of the urinary system |
Группы родильниц, n=648 Groups of postpartum women, n=648 |
X2 | P | |
|---|---|---|---|---|
| контрольная (неосложненный послеродовой период) control (uncomplicated postpartum period), n=242 |
основная (развившийся эндометрит) (developed endometritis) n=406 |
|||
| Неосложненные инфекции мочевыводящих путей: Uncomplicated urinary tract infections: |
42 (17,4) | 173 (42,6) | 43,622 | <0,001 |
| - бессимптомная бактериурия - asymptomatic bacteriuria |
15 (6,3) | 85 (20,9) | 25,324 | <0,001 |
| - цистит/cystitis | 10 (4,1) | 28 (6,9) | 2,099 | 0,148 |
| - необструктивный пиелонефрит - non-obstructive pyelonephritis |
17 (7,0) | 60 (14,8) | 8,705 | 0,004 |
| Уропатия (обструктивная): Uropathy (obstructive): |
13 (5,4) | 31 (7,7) | 1,227 | 0,268 |
| - гидронефроз, обусловленный сдавлением мочеточника маткой - hydronephrosis caused by compression of the ureter by the uterus |
13 (5,4) | 18 (4,4) | ||
| - обструктивный пиелонефрит - obstructive pyelonephritis |
0 | 11 (2,7) | ||
| - мочекаменная болезнь - urolithiasis disease |
0 | 2 (0,5) | ||
| Нефроптоз, аномалии развития Nephroptosis, developmental abnormalities |
2 (0,8) | 10 (2,5) | 2,234 | 0,135 |
| Гломерулопатии и гломерулонефриты Glomerulopathies and glomerulonephritis |
2 (0,8) | 9 (2,2) | 1,756 | 0,186 |
| Мочекаменная болезнь Urolithiasis disease |
0 | 6 (1,5) | 3,610 | 0,058 |
Второе место в сопутствующей патологии органов мочевыделительной системы у родильниц с эндометритом занимали обструктивные уропатии с нарушением пассажа мочи, обусловленным сдавлением мочеточника в нижней трети увеличенной и ротированной маткой (58,1%, 18/31), обструктивным пиелонефритом (35,4%, 11/31) и мочекаменной болезнью (6,5%, 2/31). После проведения стартовой консервативной терапии нарушение уродинамики сохранялось у 83,9% (26/31) беременных, что потребовало установки мочеточникового стента на весь период гестации с плановыми заменами и его последующим удалением через месяц после абдоминального родоразрешения. В группе контроля суправезикальная обструкция ни в одном из случаев не была обусловлена мочекаменной болезнью и не сопровождалась синдромом системной воспалительной реакции (обструктивный пиелонефрит), что обусловило стойкий эффект от консервативной терапии и отсутствие необходимости дренирования верхних мочевыводящих путей. Таким образом, стентирование мочеточника было проведено только у родильниц основной группы.
Структура нозологических форм неосложненных инфекций мочевыводящих путей при беременности в исследуемых группах была различна (рис. 2).
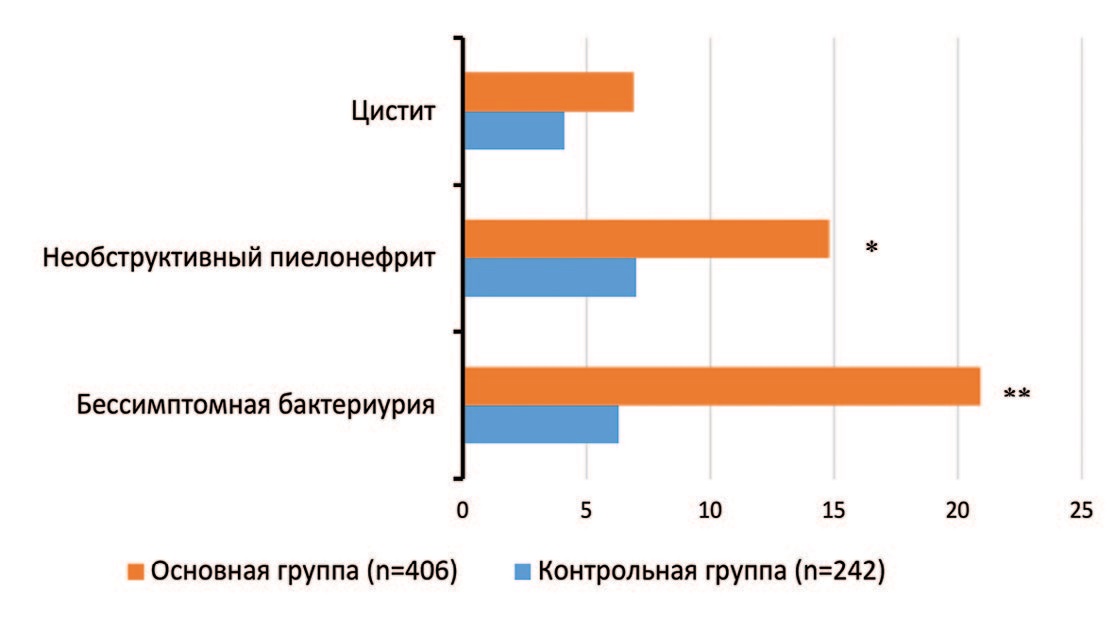
Рис. 2. Структура и частота неосложненных инфекций мочевыводящих путей при беременности у обследованных пациенток, %
Fig. 2. Structure and frequency of uncomplicated urinary tract infections during pregnancy in examined patients, %
При сравнительном анализе структуры инфекций мочевых путей между группами выявлен ряд различий. У родильниц с эндометритом при беременности ББУ выявлена в 20,9%, 85/406 случаев, а в контрольной группе – в 6,3%, 15/242 (χ2=25,234; p<0,001). Для снижения риска гипердиагностики этой патологии мы исключали все случаи несоответствия утвержденным диагностическим критериям. Большая часть пациенток с ББУ основной группы (71,8%, 61/85) при беременности с целью санации получили курс системной антимикробной терапии (рис. 3). Общий показатель превышает 100% за счет смены антимикробной терапии у части пациенток.
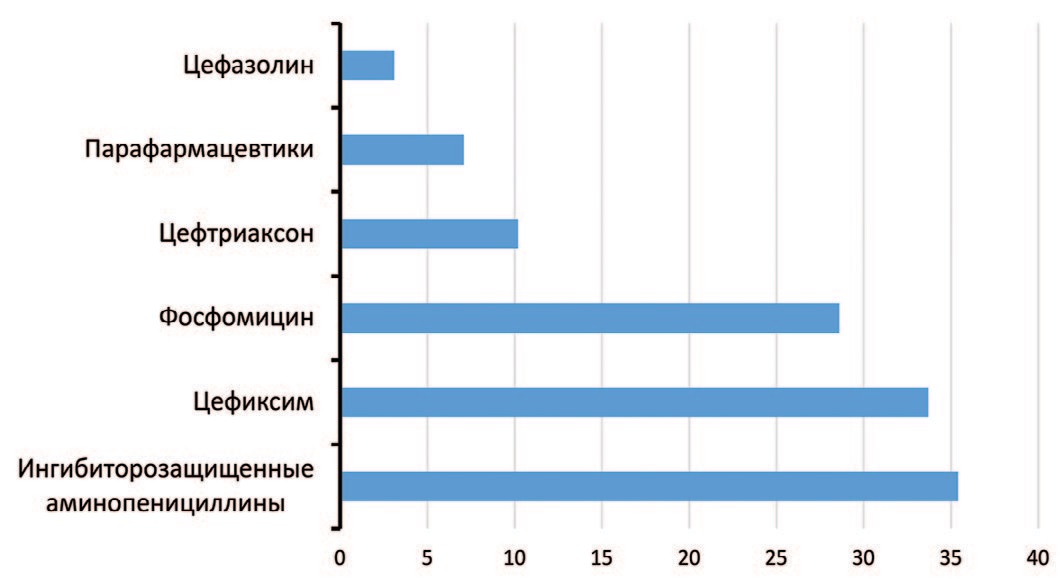
Рис. 3. Структура антимикробной химиотерапии при неосложненных инфекциях мочевыделительной системы у беременных основной группы (n=93), %
Fig. 3. Structure of antimicrobial chemotherapy for uncomplicated urinary tract infections in pregnant women of the main group (n=93), %
Эмпирическая этиотропная терапия инфекции мочевых путей состояла из β-лактамных антибиотиков, перорального фосфомицина трометамола и парафармацевтиков. Обращает на себя внимание, что антибактериальные препараты широко применяемые акушерами-гинекологами для лечения инфекций мочевыводящих путей, а также продолжительность курса лечения не всегда соответствуют клиническим рекомендациям. Несмотря на хорошие комплаентность, профиль безопасности при беременности, микробиологическую и клиническую эффективность, отмечен сравнительно невысокий уровень применения фосфомицина трометамола. В лечении неосложненной инфекции мочевых путей не применяли такие антимикробные препараты первой линии, как нитрофурантоин и фуразидин, рекомендованные отечественными и зарубежными регламентирующими документами [1, 18, 19]. Безопасность указанных препаратов при лечении ИМП в период беременности является установленной (категория действия на плод по U. S. Food and Drug Administration – B). Амоксициллин с клавулановой кислотой следует с осторожностью применять в третьем триместре из-за риска развития некротизирующего энтероколита у новорожденных. Сложно также объяснить назначение монотерапии парафармацевтиками, тератогенный потенциал, клиническая эффективность и фармакологическая безопасность которых при беременности не исследуются во всем мире. Если пациентки не реагировали на стартовую эмпирическую противомикробную терапию, то происходила смена препарата согласно полученным результатам культурального исследования мочи и антибиотикограммы.
В основной группе необструктивные пиелонефриты диагностированы в 2,1 раза чаще, чем в контрольной – 14,8%, 60/406 против 7,0%, 17/242; χ2=8,705; p=0,004 (острый гестационный – кластеры дифференцировки в Международной классификации болезней Х пересмотра N10, О23.0 и хронический тубулоинтерстициальный нефрит (пиелонефрит) – N11). Большинство диагностированных при беременности пиелонефритов протекали без осложнений. Обструктивный пиелонефрит (пионефроз, N13.6) мы отнесли в группу обструктивных уропатий.
Каждая вторая пациентка основной группы при беременности с целью лечения острого или обострения хронического пиелонефрита получила курс системной антимикробной терапии (рис. 3). При наличии хронического пиелонефрита в стадии ремисии антибактериальная терапия не назначалась. При осложненной форме пиелонефрита с симптомами обструкции беременные получали только β-лактамные антибиотики (цефтриаксон, ингибиторозащищенные пенициллины, карбапенемы), по показаниям выполнялась установка внутреннего мочеточникового стента.
Значимой разницы в частоте диагностики бактериального цистита (N30.0 – острый цистит, N30.1 – интерстициальный цистит, N30.2 – другой хронический цистит) между группами не выявлено (6,9%, 28/406 против 4,1%, 10/242; χ2=2,099; p=0,148). Этиотропное лечение цистита проведено всем пациенткам и по структуре назначенных препаратов было аналогично антимикробной терапии ББУ с обязательным культуральным исследованием мочи на чувствительность к антибиотикам. Пациенткам как правило рекомендовали длительные курсы (5-7 дней) терапии [1, 19].
Второе место в сопутствующей патологии органов мочевыделительной системы у родильниц с эндометритом занимали обструктивные уропатии. После проведения стартовой консервативной терапии нарушение уродинамики сохранялось у 83,9% (26/31) беременных, что потребовало установки мочеточникового стента на весь период гестации с плановыми заменами и его последующим удалением через месяц после абдоминального родоразрешения. В группе контроля суправезикальная обструкция ни в одном из случаев не была обусловлена мочекаменной болезнью и не сопровождалась синдромом системной воспалительной реакцией (обструктивный пиелонефрит), что обусловило стойкий эффект от консервативной терапии и отсутствие необходимости дренирования верхних мочевыводящих путей. Таким образом, стентирование мочеточника было проведено только у родильниц основной группы.
На третьем месте – аномалии положения почек (различные стадии нефроптоза и в одном случае поясничная дистопия) и аномалии их развития (неполное удвоение почек, гипоплазия, удвоение лоханки и мочеточника), однако при этом статистически значимых межгрупповых различий выявлено не было. Остальная нефро- и урологическая патология в общей когорте диагностирована с частотой около 2% и менее и существенного влияния на частоту эндометрита не оказывала.
У каждой третьей пациентки с эндометритом симптомная или бессимптомная инфекция мочевыводящих путей ассоциирована с ожирением (34,5%, 30/87) и нарушениями углеводного обмена (30,1%, 25/83), что достоверно чаще, чем у пациенток контрольной группы (10,0%, 3/30 и 13,6%, 3/22, соответственно, p<0,05). При этом 73,3% (11/15) больных сахарным диабетом 2-го типа, 16,9% (11/65) – больных гестационным сахарным диабетом, и все пациентки с сахарным диабетом 1-го типа страдали инфекцией мочевыводящих путей. У всех пациенток с индексом массы тела (ИМТ) 35,00 кг/м2 и выше при беременности была диагностирована мочевая инфекция, а при ИМТ 30,00–34,99 кг/м2 – только у 6,6% (4/61).
Анализ различий в соматическом статусе между исследуемыми группами позволил оценить их значимость в развитии эндометрита после КС. Результаты многофакторного логистического регрессионного анализа представлены в табл. 2.
Таблица 2. Результаты многомерного регрессионного анализа (факторы риска развития эндометрита)
Table 2. Results of multivariate regression analysis (risk factors for endometritis)
| Показатель (наличие заболевания или патологического состояния) Indicator (presence of disease or pathological condition) |
0Ш (95% ДИ) OR (95% CI) |
P |
|---|---|---|
| Анемия воспаления/хронического заболевания Anemia of inflammation/chronic disease |
4,12 (1,28-6,19) | <0,001 |
| Бессимптомная бактериурия Asymptomatic bacteriuria |
3,68 (1,31-4,94) | <0,001 |
| Ожирение Obesity |
3,45 (1,14-5,11) | 0,005 |
| Нарушения углеводного обмена Disorders of carbohydrate metabolism |
2,84 (1,54-3,52) | 0,012 |
| Эссенциальная гипертензия Essential hypertension |
2,14 (1,12-4,04) | 0,032 |
Примечание: ОШ – отношение шансов, ДИ – доверительный интервал
Note: OR - odds ratio, CI - confidence interval
К наиболее значимым предикторам развития эндометрита может быть отнесена анемия воспаления/ хронического заболевания. Значение отношения шансов (ОШ) для этого фактора составило 4,12 (ДИ 1,28–6,19, p<0,001). Исследование также показало, что значимыми факторами развития эндометрита после КС являются ожирение (ОШ=3,45; ДИ 1,14–5,11, p=0,005), ББУ (ОШ=3,68; ДИ 1,31–4,94, p<0,001), нарушения углеводного обмена (ОШ=2,84; ДИ 1,54–3,52; p=0,012) и артериальная гипертензия (ОШ=2,14; ДИ 1,12–4,04, p=0,032).
ОБСУЖДЕНИЕ
По результатам проведенного когортного исследования, у родильниц с эндометритом после КС патология органов мочевыделительной системы занимает лидирующую позицию в структуре коморбидной патологии, уступая только анемическому синдрому и обменно-эндокринным заболеваниям.
Наиболее часто при беременности диагностирована неосложненная симптомная и бессимптомная инфекция мочевыводящих путей. У каждой пятой пациентки с эндометритом после КС статистически чаще диагностирована бессимптомная бактериурия (20,9%) и у каждой седьмой – один из вариантов тубулоинтерстициального поражения почек (14,8%), в сравнении с пациентками контрольной группы (6,3 и 7,0%, соответственно, p<0,001).
Результаты проведенного многомерного регрессионного анализа подтвердили прогностическую значимость ББУ в предикции развития эндометрита после КС (ОШ=3,68; ДИ 1,31–4,94, p<0,001). Остается открытым вопрос о коморбидности этих заболеваний и об их возможной патогенетической связи с эндометритом (неуточненная и/или ятрогенная коморбидность). Биологический механизм ассоциации послеродового эндометрита и ББУ на данный момент окончательно не установлен.
Уропатогены, вызывающие ББУ, сходны с возбудителями послеродового эндометрита (эндогенная кишечная микрофлора) [1, 15], что свидетельствует в пользу экстрауринарной бактериальной транслокации. Ожидается, что лечение антибиотиками и эрадикация бактериурии предотвратят инфекционно-воспалительные осложнения после КС и в первую очередь развитие эндометрита. Однако на практике этого не произошло. Большинство обследованных беременных (71,8%) с диагностированной асимптомной инфекцией мочевыводящих путей с целью санации получили курс системной антимикробной терапии с последующим проведением теста на излеченность. Возможно, применение антибиотиков способствует индукции устойчивости у комменсальных бактерий после лечения и нарушению микробиоты с последующей колонизацией резистентными штаммами, что увеличивает предрасположенность к другим инфекционным заболеваниям, в данном случае, к эндометриту после КС.
Многие бактерии в микробных сообществах являются мутуалистами, которые способствуют нормальной физиологии человека, включая их участие в метаболизме, ангиогенезе, иммунном и антиинфекционном гомеостазе и т.д. Воздействуя антибиотиками на микробную экологию, можно влиять на патогенез ряда заболеваний. ББУ вне беременности без клинико-лабораторных признаков воспаления мочевыводящих путей встречается нередко и относится к комменсальной колонизации, не требующей лечения [1]. Микробиом мочевых путей защищает от суперинфекции высоковирулентными уропатогенами, а антимикробная терапия оказывает ятрогенное неблагоприятное дозозависимое воздействие на изменение баланса в микробных сообществах, способствуя эрадикации потенциально протективных и увеличению риска селекции резистентных штаммов, что демонстрирует важность здоровой микробиоты в антиинфекционной защите [20, 21].
Преинфекционные нарушения в урогенитальной микробиоте приводят к нарушению колонизационной резистентности и к повышению восприимчивости к инфекционным патогенам, а также способствуют развитию послеродовых инфекционно-воспалительных осложнений. Ингибирование микробной популяции, особенно в условиях стационара, и селективное удаление групп бактерий, ответственных за формирование барьера для колонизации и/или персистенции транзиторной микрофлоры, способствует заселению освобожденных ниш резистентными госпитальными штаммами [20].
С целью резервации β-лактамов и сохранения их эффективности у беременных для амбулаторных и стационарных пациентов с неосложненной инфекцией мочевых путей терапию следует проводить пероральными нитрофурантоином или фосфомицином, которые лучше переносятся, не проникают через плаценту и эффективны против энтеробактерий. Как показали последние исследования, нитрофурантоин активен почти в отношении 90% штаммов кишечной палочки, выделенных из мочи, включая 89% штаммов, продуцирующих β-лактамазы расширенного спектра [22]. Следовательно, β-лактамы рациональней рассматривать как препараты второй линии. Парентеральное введение ингибиторозащищенных пенициллинов показано при тяжелом, осложненном течении инфекции мочевых путей, наличии факторов риска антибиотикорезистентности возбудителя (предшествующая госпитализация, клиническая неэффективность проведенной антимикробной терапии, сопутствующие заболевания).
В настоящее время беременность все чаще рассматривается как метаболический стресс-тест, который может выявить лежащие в основе сосудистые заболевания и эндотелиальную дисфункцию [17, 23]. Существует двунаправленная связь между метаболическими заболеваниями и бактериальными инфекциями. В то время как ожирение и диабет увеличивают восприимчивость к бактериальным инфекциям и их осложнениям, ряд хронических инфекций, такие как инфекции мочевыводящих путей, связаны с повышенным уровнем провоспалительных цитокинов, которые могут усугубить резистентность к инсулину и ухудшить гликемический профиль [7, 24]. Как показало наше исследование, метаболическая патология при беременности (ожирение и нарушения углеводного обмена) является фоном для развития ряда инфекционно-воспалительных заболеваний – симптомной или бессимптомной инфекции мочевыводящих путей и анемии воспаления. Таким образом, любые заболевания или патологические состояния, повышающие уровень воспаления, индуцированного беременностью, приводят к развитию послеродовой инфекции за счет снижения материнского системного воспалительного ответа и формирования предрасположенности к инфекционным агентам [10, 25].
ЗАКЛЮЧЕНИЕ
Распространенность заболеваний органов мочевыделительной системы у родильниц с эндометритом составила 56,5% и в основном была представлена инфекцией мочевыводящих путей. ББУ осложняет течение беременности в 3,3 раза чаще у родильниц с эндометритом после КС по сравнению с соответствующим показателем у родильниц с неосложненным течением послеоперационного периода (20,9% против 6,3%; χ2=25,324; p<0,001), что позволяет отнести ее к значимым предикторам развития послеоперационных инфекционно-воспалительных осложнений в акушерстве (ОШ=3,68; ДИ 1,31–4,94, p<0,001). По результатам многомерного регрессионного анализа, менее выраженные связи с предикцией развития эндометрита после КС имел хронический и гестационный пиелонефриты.
Как показали результаты проведенного исследования и данные литературы, инфекция мочевыводящих путей ассоциирована с ухудшением имеющегося при беременности провоспалительного статуса, сопряжена с метаболическими заболеваниями (ожирением и нарушениями углеводного обмена) и развитием анемии воспаления.







