ВВЕДЕНИЕ
Хронический простатит является частым и полиэтиологичным заболеванием. К числу причин простатита относят в том числе и инфекции, преимущественно бактериальные [1]. Хронический бактериальный простатит является причиной 5-10% всех случаев простатита, из которых не менее 30% связаны с рецидивирующими инфекциями мочевыводящих путей [2].
Применение молекулярно-биологических методов при анализе бактериального разнообразия (метатаксономика) секрета предстательной железы и эякулята для оценки мужской микробиоты позволило выявить его разнообразие при хроническом простатите [3, 4]. Изучение эякулята, а не секрета предстательной железы при хроническом простатите дает возможность оценить состояние не только предстательной железы, но и других органов репродуктивной системы (семенных пузырьков, эпидидимиса и др.). Для диагностики хронического бактериального простатита метод изучения эякулята обладает более высокой чувствительностью, чем экспрессия простатического секрета [5]. Кроме того, получение эякулята, а не секрета предстательной железы достаточно практично и дает возможность пациенту собрать материал в более комфортных условиях, не прибегая к помощи медицинского персонала.
С одной стороны, ряд исследователей считает присутствие бактерий в сперме обычным явлением, в том числе и у здоровых людей [6, 7]. Семенная плазма имеет специфическую микробиоту, и возможно постулировать, что присутствие специфической бактериальной среды может быть не вредным, но естественным для нормального функционирования сперматозоидов [8, 9]. С другой стороны, показано отличие бактериального состава спермы при хроническом простатите и у здоровых людей [10, 11]. При этом многие штаммы уропатогенов, выявленных при хроническом простатите, мультирезистентны и проявляют способность к образованию биопленок [12].
Бактериальные биопленки – комплексные полимикробные структуры, состоящие из бактериальных клеток, заключенных во внеклеточный полимерный матрикс, продуцируемый этими клетками [13]. Внеклеточный матрикс состоит из многих биомолекул, включает углеводы, белки и нуклеиновые кислоты. Внеклеточный матрикс биопленок выполняет скелетную функцию, поддерживая структуру биопленки и, вероятно, помогает бактериям сопротивляться антибактериальному действию. Бактерии в структуре биопленки умеют избегать эрадикации и до 1000 раз более устойчивы к антибиотикотерапии, чем их планктонные аналоги [14].
В настоящее время нет общепринятых методов лечения биопленочных инфекций [15]. Так как чувствительность к антибиотикам бактерий в составе биопленок значительно ниже, чем в планктонном состоянии, разрабатываются методы терапии, позволяющие разрушать целостность биопленок [16]. Идет интенсивная работа над синтезом и оценкой небольших молекул, разрушающих бактериальные биопленки [17–20].
Один из подходов к терапии заболеваний, связанных с биопленками – использование ферментных препаратов. Препарат бовгиалуронидаза азоксимер представляет собой пролонгированную термостабильную форму гиалуронидазы, которая обладает мукоцидным действием, разрушая гиалуроновую кислоту фиброзной ткани при воспалительных заболеваниях, сопровождающихся фиброзом [21]. Есть публикации о положительных результатах применения лонгидазы при хроническом простатите [22].
Цель исследования: изучить действие препарата бовгиалуронидаза азоксимер при хроническом простатите, которое может быть обусловлено ферментативным действием гиалуронидазы на матрикс бактериальных биопленок, что увеличивает биодоступность антибиотиков, приводя к переходу бактерий в планктонное состояние.
МАТЕРИАЛЫ И МЕТОДЫ
Проведено электронно-микроскопическое исследование эякулята 42 пациентов хроническим простатитом, из них 32 рандомно выбранных пациента получали комбинированное антибактериальное лечение (4-6 недель) совместно с бовгиалуронидазы азоксимером (12 недель) (группа I), 10 пациентов получали только антибактериальную терапию согласно клиническим рекомендациям (группа II).
Электронно-микроскопическое исследование эякулята проводили до начала лечения и через 3 месяца после начала терапии.
Для проведения электронно-микроскопического исследования эякулят разводили изотоническим раствором хлористого натрия в 5-8 раз, добавляли 0,1 мл фиксатора (2,5% раствор глютарового альдегида на 0,1М какодилатном буфере, рН 7,2) и центрифугировали 15 мин при 3000 об/мин. К осадку добавляли 2 мл фиксатора и инкубировали в течение 2-24 час при 4оС. Осадок дофиксировали 1% раствором осмиевой кислоты, обезвоживали в этиловом спирте возрастающей концентрации и заливали в эпонаралдитовую смесь. Ультратонкие срезы получали на ультрамикротоме «UltraCut 111», окрашивали цитратом свинца и изучали в электронном микроскопе «JEM 100S» при увеличении х5000 (общий просмотр) и х16000–х18000 (исследование органоидов).
На ультратонких срезах подсчитывали количество бактериальных микроколоний и нейтрофильных лейкоцитов на 100 сперматозоидов.
РЕЗУЛЬТАТЫ
Бактериальные микроколонии были обнаружены в сперме 24 пациентов группы I и 6 пациентов группы II.
В процессе лечения 24 пациентов I группы, имеющих бактериальные микроколонии, у 12 (50%) их количество уменьшилось, а у 9 (37,5%) – не обнаруживались, у 3 (12,5%) – количество колоний не изменилось, из 6 больных II группы такие же изменения отмечены у 2 (33,3%), 1 (16,6%) и 3 (50%) больных соответственно. Снижение количества нейтрофилов отмечено у 22 (68,7%) больных I группы и 3 (30%) пациентов - II группы группы (табл. 1, 2).
Таблица1. Количество пациентов в I и II группах, имеющих бактериальные микроколонии в сперме, до и после терапии
Table 1. The number of patients in groups I and II with bacterial microcolonies in semen before and after therapy
| Группа Group |
Количество пациентов в группе Quantity patients in the group |
Количество больных, имеющих колонии до лечения Number of patients with colonies before treatment |
Количество больных, у которых количество колоний уменьшилось The number of patients in whom the number of colonies decreased |
Количество больных, у которых колонии после лечения не обнаружены The number of patients in whom no colonies were found after treatment |
Количество больных, у которых количество колоний не изменилось The number of patients in whom the number of colonies did not change |
Количество больных, у которых колонии до и после лечения не обнаружены The number of patients in whom colonies were not found before and after treatment |
|---|---|---|---|---|---|---|
| Группа I Group I |
32 | 24 | 12 | 9 | 3 | 8 |
| Группа II Group II |
10 | 6 | 2 | 1 | 3 | 4 |
Таблица 2. Количество пациентов I и II групп, у которых изменилось количество нейтрофильных лейкоцитов в сперме после терапии
Table 2. The number of patients of groups I and II in which the number of neutrophilic leukocytes in semen has changed
| Группа Group |
Количество пациентов в группе Quantity patients in the group |
Количество больных, у которых количество нейтрофилов уменьшилось The number of patients in whom the number of neutrophils decreased |
Количество больных, у которых количество нейтрофилов не изменилось The number of patients in whom the number of neutrophils did not change |
Количество пациентов, у которых нейтрофилы до и после лечения не обнаружены The number of patients in whom neutrophils were not detected before and after treatment |
|---|---|---|---|---|
| Группа I Group I |
32 | 22 | 5 | 5 |
| Группа II Group II |
10 | 3 | 6 | 1 |
В процессе лечения у большинства пациентов группы I наблюдали количественные изменения содержания бактериальных колоний и нейтрофильных лейкоцитов (расчет на 100 сперматозоидов). Среднее количество бактериальных микроколоний до лечения было 11,4 в группе I и 10,3 – в группе II. После лечения среднее количество микроколоний было 4,1 в группе I и 6,2 – в группе II. Среднее количество нейтрофильных лейкоцитов до лечения было 14,8 в группе I и 16,0 в группе II. После лечения среднее количество нейтрофильных лейкоцитов было 4,7 в группе I и 14,2 в группе II.
Существенные изменения выявлены в морфологии бактериальных колоний. До лечения бактериальные микроколонии можно охарактеризовать как биопленки по характерным признакам: наличие гетерогенных микроорганизмов в одной микроколонии, наличие волокнистого матрикса, в который погружены бактерии.
На рис.1 представлены грамотрицательные бактерии, заключенные в волокнистый матрикс; на рис. 2 волокнистый матрикс окружает грамположительные и грамотрицательные бактерии. После терапии в группе I выявляются лежащие отдельно единичные бактерии (планктонное состояние) (рис.3), в ряде случаев обнаруживается повреждение клеточной стенки бактерий (рис. 4). В группе II также выявлены количественные изменения содержания микроколоний и нейтрофильных лейкоцитов, однако морфология микроколоний в группе II не меняется.
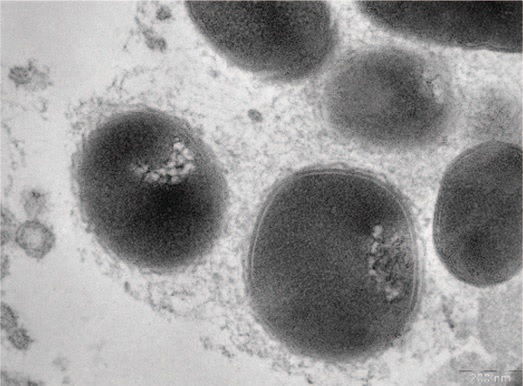
Рис.1. Грамотрицательные бактерии, заключенные в волокнистый матрикс, формируют биопленку в эякуляте (пациент группы I, до лечения)
Fig.1. Gram-negative bacteria, enclosed in a fibrous matrix, form a biofilm in the ejaculate (group I patient, before treatment)
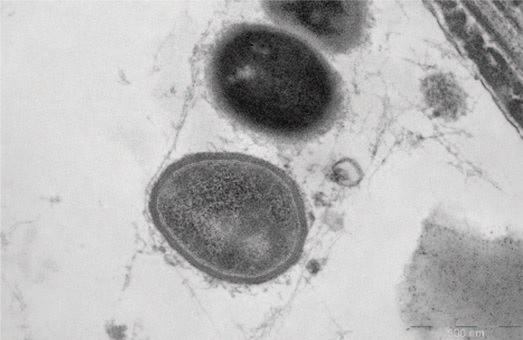
Рис.2. Грамположительные и грамотрицательные бактерии, заключенные в волокнистый матрикс, формируют биопленку в эякуляте (пациент группы I, до лечения)
Fig.2. Gram-positive and gram-negative bacteria, enclosed in a fibrous matrix, form a biofilm in the ejaculate (group I patient, before treatment)
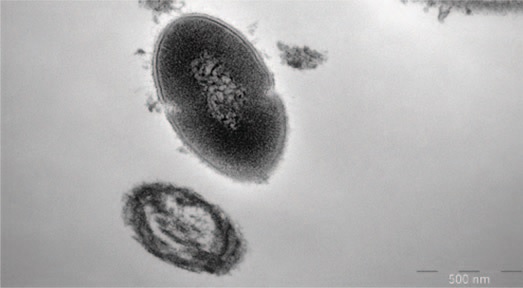
Рис.3. Грамотрицательная бактерия в планктонном состоянии. Матрикс вокруг бактриии отсутствует
Fig.3. Gram-negative bacterium in the planktonic state. There is no matrix around the bactria. Group 1 patient after treatment
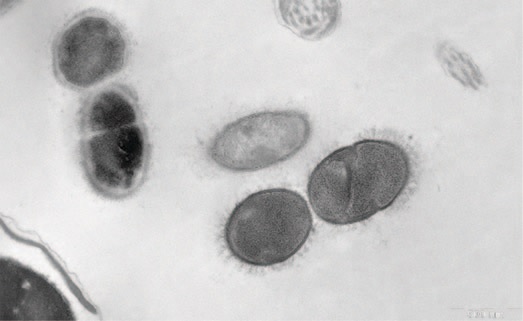
Рис.4. Грамположительные бактерии с поврежденной клеточной стенкой. Пациент группы I после лечения
Fig.4. Gram-positive bacteria with damaged cell walls. Group I patient after treatment
ОБСУЖДЕНИЕ
Для визуализации биопленок чаще всего используется сканирующая электронная микроскопия, позволяющая определять трехмерную структуру биопленки [23, 24]. Этот метод позволяет исследовать топографию и плотность биопленки на поверхности образца. Однако трансмиссионная электронная микроскопия, несмотря на сложный процесс пробоподготовки, считается золотым стандартом, позволяющим оценить внутреннюю структуру биопленки и наблюдать изменения матрикса в процессе терапии [25, 26]. Это важный момент, так как именно наличие внеклеточного полимерного матрикса в биопленках затрудняет действие противомикробных препаратов и делает бактерии устойчивыми к антибиотикам и другим лекарственным средствам [27].
Интересные результаты были получены при добавлении Лонгидазы® к стандартной антибактериальной терапии в лечении хронического простатита. Отмечалось снижение клинического индекса хронического простатита, а также уменьшение размера очагов плотности, фиброза в тканях предстательной железы, обогащение сосудистого рисунка, повышение скорости потока крови в сосудах [28, 29]. В настоящей работе мы показали изменение количества активных нейтрофилов в эякуляте, что является показателем уменьшения выраженности воспалительного процесса. В контрольной группе (антибиотики без добавления лонгидазы) содержание нейтрофильных лейкоцитов в эякуляте практически не изменилось.
Ключевым аспектом данного исследования является оценка эффективности бовгиалуронидазы азоксимера в отношении возможности разрушения биопленок, формирующих защиту микроколоний различных бактерий в эякуляте и способствующих устойчивости микроорганизмов к антимикробной терапии. Ранее подобные эффекты Лонгидазы® были изучены исключительно in vitro [30]. Наше исследование является первым, доказывающим этот эффект in vivo. Благодаря применению электронной микроскопии были обнаружены различия в эякуляте пациентов до и после лечения. Данные различия отмечались именно в группе пациентов, получавших бовгиалуронидазу азоксимер: продемонстрировано уменьшение количества колоний микробов, окруженных матриксом различной природы, чаще мукополисахаридной (биопленки), либо изменения морфологии самих микроколоний. Исчезновение межклеточного матрикса и переход бактерий в планктонную форму существования является показателем разрушения бактериальных биопленок. В контрольной группе подобных изменений не происходило.
ЗАКЛЮЧЕНИЕ
Применение трансмиссионной электронной микроскопии при исследовании эякулята пациентов с хроническим простатитом позволяет выявить особенности структуры бактериальных биопленок в процессе терапии. В настоящей работе показали, что при комбинированной антибактериальной терапии совместно с бовгиалуронидазы азоксимером изменяется матрикс биопленок и происходит переход бактерий в планктонную форму.







