ВВЕДЕНИЕ
Хроническая болезнь почки (ХБП) является всемирной проблемой, затрагивая миллионы людей всех рас, возрастных и этнических групп [1]. По данным клинического центра эпидемиологических исследований города Сент-Луиса, в мире происходит ежегодное увеличение заболеваемости ХБП [2]. Постоянный рост общей и первичной заболеваемости отмечается и в Российской Федерации [3].
Все стадии ХБП сопряжены с увеличением риска некоторых соматических заболеваний, снижением качества жизни и увеличением смертности [4, 5]. По литературным данным, смертность у пациентов с ХБП в 2,7 раз выше по сравнению с людьми без ХБП. Отмечается увеличение смертности от заболеваний сердечно-сосудистой системы (в 10-41 раза), сахарного диабета (в 13 раз), инфекционных заболеваний и сепсиса, некоторых видов рака, в том числе легких и почек [4-7].
Наиболее изученными причинами развития ХБП являются артериальная гипертензия, сахарный диабет и гломерулопатии [8, 9]. Следует отметить, что при всех этих заболеваниях происходит двухстороннее поражение почек, в связи с чем, у части пациентов происходит значительное снижение функции почек [10-12]. Следует отметить, что многие гломерулярные поражения, независимо от своего происхождения, протекают бессимптомно или малосимптомно, что затрудняет их диагностику. Несвоевременная диагностика поражения клубочков неизбежно приводит к снижению скорости клубочковой фильтрации [8].
Другой причиной развития ХБП является хронический тубуло-интерстициальный нефрит, характеризующийся воспалительной инфильтрацией стромы почки и канальцев [13-17]. Существует достаточно большое количество причин развития хронического тубуло-интертициального нефрита, который в зависимости от этиологии может быть как односторонним, так и двухсторонним [13]. Однако, его вклад в развитие и течение ХБП недостаточно изучен, что может быть связано с его поздней диагностикой [7]. По данным регистра USRDS (США), в 2017 г. количество неясных причин, приводящих к терминальной ХБП, к которым отнесен и тубуло-интерстициальный нефрит, составляет 14,4% [18]. Анализ популяции пациентов на заместительной почечной терапии в Красноярском крае, свидетельствует о большем количестве этой патологии. Доля заболеваний урологической этиологии, приведшей к заместительной почечной терапии, включая хронический тубуло-интерстициальный нефрит, составляет 29%, уступая лишь гломерулопатиям [19].
Цель исследования – оценить результаты интраоперационной биопсии почки при урологических заболеваниях для выявления возможных морфологических предикторов развития ХБП.
МАТЕРИАЛЫ И МЕТОДЫ
Проспективное когортное исследование включило 30 пациентов, которым проводилось оперативное лечение в отделении урологии Красноярской Краевой клинической больницы, которым был установлен один из вышеописанных диагнозов. Все пациенты из данных анамнеза не имели гломерулярного поражения. Процедура исследования, соответствуют стандартам этического комитета организации, Хельсинкской декларации 1964 года и ее последующим изменениям, подтверждена выпиской из протокола локально-этической комиссии КГБУЗ Красноярской краевой клинической больницы №189/6 от 29.09.2022. Каждый пациент, включенный в исследование, подтверждал свое участие получением добровольного информированного согласия. Критериями включения в исследование являлись пациенты в возрасте от 18 лет с диагнозами гидронефроз на фоне обструкции пиелоуретерального сегмента и сохраненной функцией почки, объемное образование почки (киста или опухоль), которым было показано оперативное лечение. Пациенты с наличием тяжелых экстраренальных сопутствующих заболеваний в стадии декомпенсации, а также больные с клиническими проявлениями обострения хронического пиелонефрита из исследования исключались. Возраст пациентов находился в диапазоне от 21 до 79 лет, медиана возраста составила 55,1 лет (16 мужчин и 14 женщин). Характеристика пациентов представлена в таблице 1.
Таблица 1. Характеристика пациентов, которым проведена интраоперационная нефробиопсия
Table 1. Characteristics of patients associated with intraoperative nephrobiopsy
|
Критерий / Variable |
Значение показателя / Value |
|---|---|
|
Возраст / Age |
|
|
18-45 |
7 |
|
46-60 |
7 |
|
Более 60 / Over 60 |
16 |
|
Пол / Sex |
|
|
Женский/Female |
14 |
|
Мужской/Male |
16 |
|
Заболевание / disease |
|
|
Киста почки/ kidney cyst |
14 |
|
Стриктура пиелоуретерального сегмента / Pyeloureteral junction stricture obstruction |
7 |
|
Опухоль почки/ kidney tumor |
9 |
Оперативное лапароскопическое вмешательство на почке выполнялось с использованием стандартного набора эндовидеоскопического оборудования и инструментов (инсуфлятор, головка видеокамеры, блок видеосистемы, источник света, электрохирургический генератор, троакары, окончатый зажим, диссектор, трубка для аспирации и другие).
Непосредственно получение ткани почки производилось с использованием пункционной режущей иглы гильотинного типа 16G длиной 160 мм с возможностью выбора забора столбика материала длиной до 22 мм и шириной 1,2 мм. Материал, полученный при нефробиопсии, доставлялся в лабораторию в 0,9% растворе натрия хлорида. Доставленные столбики ткани разделялись для светооптической микроскопии, реакции иммуннофлуоресценции, электронной микроскопии. Проводка образцов для светооптического исследования проводилась по стандартной методике. Препараты окрашены гематоксилином и эозином, Конго-рот, импрегнирование препаратов почки метенамин, серебром выполнена ШИК (PAS) реакция, и трихромная окраска по Массону. Реакция иммуннофлюоресценции выполнена с применением антител к IgM – FITC, clone: poly(DBS), IgA–FITC, clone: poly (DBS), IgG – FITC, clone: poly(DBS), C3c – FITC, clone: poly(DBS), C1q – FITC, clone: poly(DBS), Kappalightchain – FITC, clone: poly(DBS) и Lambdalightchain – FITC, clone: poly(DBS). Оценка препаратов проводилась с применением флуоресцентного микроскопа ZeissAxioImagerZ2 (Германия). Фиксация и проводка материала для электронной микроскопии проводилась по стандартной методике с контрастированием срезов 0,1% раствором цитрата свинца. Электронномикроскопическое исследование образцов проводилось с применением просвечивающего электронного микроскопа ZeissLibra 120 PLUS (Германия) в режиме TEM при различных увеличениях и выполнением картирования изображения для формирования обзорных снимков. Оценке подлежали снимки изображения, полученные камерой TRS Dualspeed 220V 50-60Hz, SN 441/13. Морфометрический анализ получаемых изображений выполнялся с применением программного обеспечения OlympusiTEM.
Методика проведения биопсии почки под визуальным контролем
Основным этапом биопсии почки при лапароскопическом доступе является пункция. Процедура проводится в операционной на завершающем этапе лапароскопического оперативного вмешательства. Проведение манипуляции не требует использования дополнительного инструмента, за исключением полуавтоматической пункционной режущей иглы гильотинного типа 16G длиной 160 мм с возможностью получения столбика материала длиной до 22 мм и шириной 1,2 мм.
Выделение почки из окружающих тканей и подготовка необходимого участка для биопсии производится с использованием основных лапароскопических инструментов: окончатый зажим, диссектор, трубка для аспирации и других с применением электрохирургического генератора.
Использование биопсийной иглы полуавтоматического типа подразумевает активацию пускового механизма иглы до пункции. Наиболее оптимальная глубина забора материала почки составляет 22 мм, но может быть уменьшена до 15 мм при наличии выраженных явлений нефросклероза при дооперационном обследовании.
Биопсийная игла в брюшную полость проводится чрескожно вне зоны ранее установленных лапароскопических троакаров. Проекция пункции выбирается индивидуально в зависимости от топографо-анатомического расположения почки, наиболее часто проводится по передней или средней аксиллярной линии. После проведения иглы в брюшную полость вкол желательно выполнить по линии Цондека, в зоне, где система передней зональной ветви почечной артерии граничит с задней, располагающейся в пределах 0.5-0.75 см кзади от середины наружного края почки (рис. 1) [20].
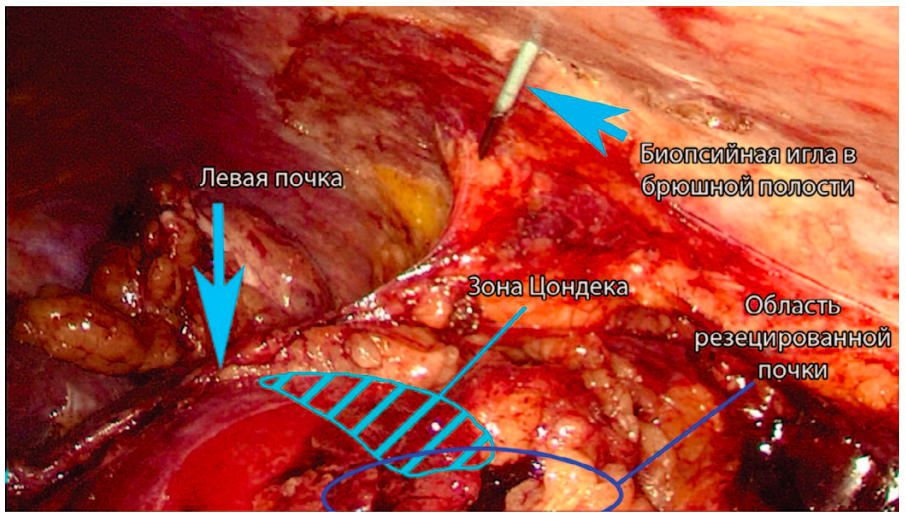
Рис. 1. Интраоперационное проведение биопсийной иглы в брюшную полость
после выполненной лапароскопической резекции левой почки
Fig. 1. Intraoperative insertion of a biopsy needle into the abdominal cavity after
laparoscopic resection of the left kidney
Получение материала с помощью биопсии почки из этой зоны минимизирует риски развития кровотечения. Желательное позиционирование точки получения материала в зоне удаленности от края оперативного вмешательства не менее, чем на 10 мм. Однако, наиболее объективный нативный материал почки получен на удалении 2,5-3 см от края оперативного вмешательства. Следующим этапом является непосредственное получение материала, который реализуется путем введения мандрена в паренхиму поступательным движением вперед спускового механизма, после чего производится самопроизвольный отстрел при активации кнопки спускового механизма. Ткань почки срезается гильотинным методом и находится внутри биопсийной иглы, которая извлекается из пациента (рис. 2).
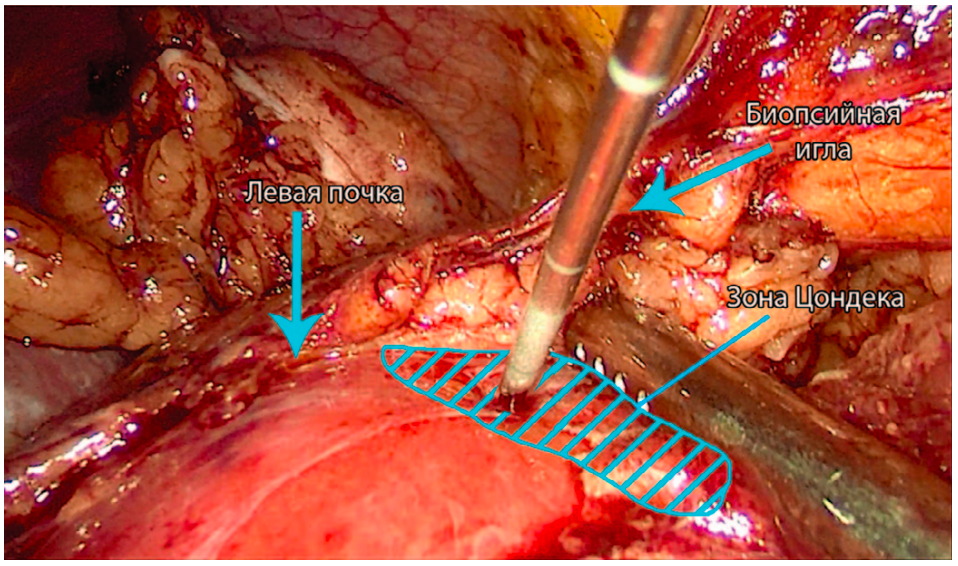
Рис. 2. Лапароскопическая нефробиопсия слева
Fig. 2. Laparoscopic nephrobiopsy on the left
Интенсивность кровотечения непосредственно после проведения пункционной биопсии контролируется визуально. Достижение гемостаза осуществляется моно- или биполярной коагуляцией, хотя возможно применение и других хирургических методов гемостаза вплоть до прошивания паренхимы почки нитью, однако в наших наблюдениях необходимости в этом не было.
Изъятие столбика биоптата из иглы производится экстракорпорально путем повторной активации спусковой механизма. Полученный материал помещается в 0,9% раствор натрия хлорида и доставляется в патологоанатомическое отделение для исследования в сроки до 3-х часов. Отсутствие фиксации биопсийного материала в формалине позволяет провести реакцию иммунофлюоресценции и электронную микроскопию. При невозможности транспортировки в течении 3 часов от момента получения материала, образцы могут быть зафиксирован в растворе 10% забуференного формалина, что ограничивает проведение реакции иммунной флуоресценции и электронной микроскопии, но позволяет провести другие методы исследования.
Необходимо добиться получения трех столбиков ткани почки, поэтому манипуляция проводится минимум 3 раза. При необходимости, процедура может быть выполнена дополнительно, если количество материала оказалось недостаточным.
Описанная выше методика является собственной разработкой, в изученной доступной медицинской литературе, в том числе в электронных базах данных PubMed, Elibrary другими авторами ранее не была описана и не запатентована.
РЕЗУЛЬТАТЫ
Было исследовано 30 образцов пункционных нефробиопсий, выполненных под визуальным контролем, полученных при проведении лапароскопических операций на почке. Проводка и окраска образцов были проведены по стандартной методике. Толщина срезов составила 2,5-3 мкм, что позволяет оценить структуры клубочка, канальцы, воспалительный инфильтрат, сосуды стромы. Также были выполнены реакция иммунной флуоресценции и электронная микроскопия. Полученные результаты не отличались от образцов, полученных по классической методике пункционной нефробиопсии под контролем УЗИ. Послеоперационных осложнений, связанных с биопсией почки, выше 1 класса по шкале Clavien-Dindo зафиксировано не было.
Качество полученного материала почки оценивалось наличием тканей мозгового и коркового слоя почечной паренхимы. Количество клубочков в полученных биоптатах варьировало от 5 до 25, в среднем составило 12,68+6,88. Глобально склерозированные клубочки зафиксированы у 9 пациентов, из которых трое оперированы по поводу опухоли почки, четверо с диагнозом киста почки и двое со стриктурой пиелоуретерального сегмента. Доля глобально склерозированных клубочков у этих пациентов составила 14,56%. Мезангиальная пролиферация отмечена в 5 образцах (16,7%), при этом основную часть (80%) составили пациенты, оперированные по поводу злокачествественного образования почки. Атрофия канальцев находилась в диапазоне от 5% до 100% и отмечена в 18 биоптатах: 22,3% – при гидронефрозе, 44,4% – у пациентов с опухолью почки и 33,3% при кистах почки. Склероз сосудов до 100% отмечен у двух пациентов, оперированных по поводу стриктуры пиелоуретерального сегмента, гиалиноз сосудов зафиксирован у одной пациентки с папиллярной почечно-клеточной карциномой. Явления воспалительной инфильтрации интерстициальной ткани выявлены у всех пациентов, однако умеренная и высокая степень активности отмечена у 10 пациентов (33,3%), из которых наибольшую группу (n=5) составили пациенты, оперированные по поводу опухолевых образований почки, в меньшем количестве по поводу кист (n=3) и два пациента со стриктурами пиелоуретерального сегмента.
Ранее не диагностированное гломерулярное поражение зафиксировано у двух пациентов (6,7%). Одному пациенту диагностирована системная красная волчанка с установлением класса люпус нефрита IV G A/C, у второго – фокальный сегментарный гломерулосклероз.
Таким образом, по результатам проведения 30 нефробиопсий, полученных при лапароскопических операциях на почке в 6,7% впервые диагностировано латентно протекающее гломерулярное заболевание и в 33,3% умеренные или выраженные явления тубуло-интерстициального нефрита. Кроме этого, мезангиальная пролиферация и атрофия канальцев отмечены в 63,3% полученных биоптатах.
Имеющиеся морфологические данные о состоянии паренхимы почки при выполнении органосохраняющих операций на почке, могут повлиять на дальнейшую тактику лечения пациентов для своевременного назначения нефропротективной терапии с целью снижения риска прогрессии ХБП.
ОБСУЖДЕНИЕ
Одной из современных мировых проблем является хроническая болезнь почек, причины развития которой весьма разнообразны. Немалая доля пациентов не имеет явной клинической картины, в связи с чем, заболевание зачастую остается не диагностированными. Отсутствие своевременно назначенного лечения приводит к прогрессированию явлений ХБП. Ранняя диагностика в этой ситуации имеет определяющее значение.
Существует определенный четкий перечень нефрологических показаний, при которых показана нефробиопсия: ренальная острая почечная недостаточность неуточненной этиологии или когда этот процесс сопровождается системной манифестацией, васкулитом, гломерулонефритом; нефропатия с явлениями органической протеинурии, клубочковой гематурии, нефротического синдрома; невыясненного генеза почечная гипертензия; тубулопатия неуточненной этимологии; заболевание трансплантата почки [21, 22]. Ограниченный перечень состояний для нефробиопсии в первую очередь обусловлен возможным развитием тяжелых осложнений, таких как паранефральная гематома, артериовенозная фистула, перфорация кишечника и другие, связанные в первую очередь с тем, что процедура проводится лишь под ультразвуковым наведением и не контролируется полностью.
Лапароскопическая нефробиопсия позволяет провести визуально контролируемое получение биоптата почечной паренхимы и может быть использована как дополнительная опция для выявления латентных заболеваний почек. При этом основным показанием для оперативного вмешательства является наличие урологического заболевания, а выполнение интраоперационной биопсии расширяет возможности диагностического поиска морфологического субстрата прогрессии ХБП.
Изученные литературные данные не описывают методики получения нефробиопсии под визуальным контролем во время проведения лапароскопической операции. Однако, для некоторых пациентов данный метод может стать единственной возможностью диагностики поражения почек и назначения необходимой терапии. Материал, полученный с применением описанной методики, по диагностической ценности не уступает нефробиопсии, полученной по классической методике под контролем УЗИ, а сама процедура является безопасной, контролируемой и не представляет сложностей проведения у оперирующего врача.
ЗАКЛЮЧЕНИЕ
Интраоперационная визуально-контролируемая нефробиопсия является безопасным, простым методом оценки морфофункционального состояния почечной паренхимы, позволяющая, не изменяя хода хирургического вмешательства на почке, провести диагностику латентных заболеваний, в том числе на этапе доклинических проявлений. Внедрение в практику описанной выше методики позволяет расширить понимание врача о наличии изменений в почке, что способствует своевременному назначению пациентоориентированной терапии с пролонгированием периода до развития необратимых изменений нефросклероза и прогрессии ХБП.
Настоящая фаза исследования дает возможность заключиться, что у 63,3% пациентов с урологической патологией почки имеются морфологические предикторы развития и прогрессии ХБП, при этом 33,3% пациентов уже имеются признаки тубуло-интерстициального нефрита неизбежно приводящему к склерозированию почечной паренхимы. Однако, наибольшей ценностью является диагностика латентно протекающих гломерулопатий, которые были выявлены у 6,7% пациентов и уже в раннем послеоперационном периоде были консультированы нефрологом с назначением необходимой терапии, направленной уже на лечение гломерулярной патологии.
ЛИТЕРАТУРА
1. Tomino Y. Diagnosis and treatment of patients with IgA nephropathy in Japan. Kidney research and clinical practice 2016;35(4):197-203.
2. Xie Y, Bowe B, Mokdad AH, Xian H, Yan Y, Li T, et al. Analysis of the Global Burden of Disease study highlights the global, regional, and national trends of chronic kidney disease epidemiology from 1990 to 2016. Kidney international 2018;94(3):567-581.
3. Румянцева Е.И. Хроническая болезнь почек как глобальная проблема для общественного здоровья: динамика заболеваемости и смертности. Проблемы стандартизации в здравоохранении 2021(1-2):41-49. [Rumyantseva E.I. Chronic kidney disease as a global public health problem: dynamics of morbidity and mortality. Problemy standartizacii v zdravoohranenii = Health care Standardization Problems 2021(1-2):41-49. (in Russian)].
4. Aune D, Sun X, Nie J, Huang W, Liao B, Wang Y. Self-reported chronic kidney disease and the risk of all-cause and cause-specific mortality: outcome-wide association study of 54 causes of death in the National Health Interview Survey. BMC nephrology 2022;23(1):1-8.
5. Angelantonio ED, Chowdhury R, Sarwar N, Aspelund T, Danesh J, Gudnason V. Chronic kidney disease and risk of major cardiovascular disease and non-vascular mortality: prospective population based cohort study. BMJ 2010;341 p.
6. Carracedo J, Chowdhury R, Sarwar N, Aspelund T, Danesh J, Gudnason V. Mechanisms of cardiovascular disorders in patients with chronic kidney disease: a process related to accelerated senescence. Frontiers in Cell and Developmental Biology 2020;8:185 p.
7. Jankowski J, Floege J, Fliser D, Böhm M, Marx N. Cardiovascular disease in chronic kidney disease: pathophysiological insights and therapeutic options. Circulation 2021;143(11):1157-1172.
8. Colvin RB, Chang A, Cornell LD. Diagnostic pathology: kidney diseases. Amsterdam: Elsevier 2016;828-849.
9. Жариков А.Ю., Щекочихина Р.О. Диабетическая нефропатия. Современный взгляд на проблему. Бюллетень медицинской науки 2018;2(10):24–31. [Zharikov A.Yu., Shchekochikhina R.O. diabetic nephropathy. Modern view of the problem. Byulleten' medicinskoj nauki = Bulletin of Medical Science 2018;2(10):24–31. (In Russian)].
10. Мельникова Л.В., Осипова Е.В. Поражение почек при эссенциальной артериальной гипертензии: патогенетические основы ранней диагностики. Артериальная гипертензия 2019;25(1):6-13. [Melnikova L.V., Osipova E.V. Kidney damage in essential arterial hypertension: pathogenetic basis for early diagnosis. Arterial'naya gipertenziya = Arterial hypertension 2019;25(1):6-13. (In Russian)].
11. Добронравов В.А., Смирнов А.В. Этиология и клинико-морфологическая презентация мембранопролиферативного гломерулонефрита в российской популяции. Нефрология 2018;22(4):9-17. [Dobronravov V.A., Smirnov A.V. Etiology and clinical and morphological presentation of membranoproliferative glomerulonephritis in the Russian population. Nefrologiya = Nephrology 2018;22(4):9-17. (In Russian)].
12. Исмаилов И.Я., Скворцов В.В. Хронический гломерулонефрит. Медицинская сестра 2018;20(6):17-20. [Ismailov I.Ya., Skvortsov V.V. Chronic glomerulonephritis. Medicinskaya sestra = The Nurse 2018;20(6):17-20. (In Russian)].
13. Joyce E, Glasner P, Ranganathan S, Swiatecka-Urban A. Tubulointerstitial nephritis: diagnosis, treatment, and monitoring. Pediatr Nephrol 2017;32(4):577-587. http://doi.org/10.1007/s00467-016-3394-5.
14. Fogo AB, Lusco MA, Najafian B, Alpers CE. AJKD Atlas of Renal Pathology: Chronic Interstitial Nephritis. Am J Kidney Dis 2017;70(1):e1-e2. http://doi.org/10.1053/j.ajkd.2017.05.002.
15. Oyama S, Hosohata K, Inada A, Niinomi I, Mori Y, Yamaguchi Y, Uchida M, Iwanaga K. Drug-induced tubulointerstitial nephritis in a retrospective study using spontaneous reporting system database. Ther Clin Risk Manag 2018;(14):1599-1604. http://doi.org/10.2147/TCRM.S168696.
16. Perazella MA. Clinical Approach to Diagnosing Acute and Chronic Tubulointerstitial Disease. Adv Chronic Kidney Dis 2017;24(2):57-63. http://doi.org/10.1053/j.ackd.2016.08.003.
17. Ayasreh-Fierro N, Ars-Criach E, Lopes-Martín V, Arce-Terroba Y, Ruiz-del Prado P, Ballarín-Castán J, Torra-Balcells R. Familial chronic interstitial nephropathy with hyperuricaemia caused by the UMOD gene. Nefrologia 2013;33(4):587-92; English, Spanish; http://doi.org/10.3265/ Nefrologia.pre2013.Apr.11960.
18. USRDS 2019. Annual Data Report. Electronic publication. URL: https://www.usrds.org/annual-data-report/current-adr/Accessed: 25.09.2020.
19. Симонов П.А., Фирсов М.А., Дунц Д.А., Безруков Е.А., Ивлиев С.В. Роль урологической патологии в развитии терминальной почечной недостаточности. Consilium Medicum 2022;24(10):759–762. [Simonov P.A., Firsov M.A., Dunts D.A., Bezrukov E.A., Ivliev S.V. The role of urological pathology in the development of terminal renal failure. Consilium Medicum 2022;24(10):759–762. (In Russian)]. http://doi.org/10.26442/20751753.2022.10.201927.
20. Ajmani ML. To study the intrarenal vascular segments of human kidney by corrosion cast technique. ML. Ajmani, K Ajmani. Anat Anz 1983;154(4):293-303.
21. Мухин Н.А. Нефрология: национальное руководство; М.: ГЭОТАР-Медиа 2009;720 с. [Mukhin N.A. Nephrology: national guidelines; M.: GEOTAR-Media 2009; 720 p. (In Russian)].
22. Мухин Н.А., Тареева И.Е., Шилов Е.М., Козловская Л.В. Диагностика и лечение болезней почек; М.: ГЭОТАР-Медиа 2011;384 с. [Mukhin N.A., Tareeva I.E., Shilov E.M., Kozlovskaya L.V. Diagnosis and treatment of kidney diseases; M.: GEOTAR-Media 2011; 384 p. (In Russian)].







