ВВЕДЕНИЕ
Выявление метахронных опухолей у пациентов, перенесших радикальные онкологические операции, является важной и актуальной проблемой не только онкологии, но и медицины в целом [1].
В данной статье мы представляем случай клинической манифестации уротелиального рака правого мочеточника спустя 21 месяц после удаления меланомы и 6 месяцев после перенесенной радикальной простатэктомии.
Диагностика папиллярных опухолей верхних мочевых путей является весьма трудной задачей в связи с ограниченной диагностической ценностью рутинных методов диагностики (ультразвукового исследования – УЗИ, экскреторной урографии, мультиспиральной компьютерной томографии – МСКТ и магнитно-резонансной томографии – МРТ) [2]. Использование современного эндоскопического оборудования, усиленного новейшими технологиями обработки получаемого изображения (NBI, Image 1S и др.) позволяют не только улучшить визуализацию новообразований, но и точнее определять мультифокальность поражения и границы роста опухоли [3]. Усовершенствование гибких фиброуретеропиелоскопов и создание цифровых гибких эндоскопов, позволяющих осмотреть весь уротелий, разработка специальных биопсийных щипцов для получения морфологического материала и накопление опыта лазерной вапоризации способствует расширению показаний к применению органосохраняющего лечения уротелиальной карциномы верхних мочевых путей [4].
Наше наблюдение иллюстрирует современные возможности применения эндоскопических методов диагностики и органосохраняющего лечения папиллярных опухолей верхних мочевых путей у пациента, проходившего контрольное обследование после выполнения ему удаления меланомы надлопаточной области и радикальной простатэктомии по поводу локализованного рака предстательной железы (ПЖ).
КЛИНИЧЕСКОЕ НАБЛЮДЕНИЕ
Больной В., 55 лет поступил во 2-ое урологическое отделение ГКБ имени Д.Д. Плетнева с жалобами на примесь крови в моче, учащенное мочеиспускание, дискомфорт в поясничной области справа. Из анамнеза известно, что в октябре 2013 года было выполнено хирургическое лечение в объеме иссечения образования левой надлопаточной области. Гистологическое заключение: эпителиоидноклеточная меланома низкой степени дифференцировки. В последующем пациент находился под наблюдением онколога по месту жительства. В июле 2014 года при контрольном обследовании по данным УЗИ шеи справа, обнаружены гипоэхогенные очаги, по поводу чего была выполнена лимфаденэктомия справа. Гистологическое заключение: опухолевого роста не обнаружено. Далее при комплексном онкологическом обследовании выявлено повышение уровня ПСА крови до 7,63 нг/мл. В декабре 2014 года выполнена биопсия ПЖ, диагностирована мелкоацинарная аденокарцинома (3+3=6 баллов по шкале Глисона). Проведено обследование в объеме «расширенного онкопоиска» – МРТ органов малого таза, МСКТ грудной клетки и легких, остеосцинтиграфия, гастро- и колоноскопия. По данным обследования признаков местного распространения опухолевого роста и наличия метастазов меланомы и рака ПЖ не выявлено. В феврале 2015 года пациенту произведена экстраперитонеоскопическая простатэктомия. Гистологическое заключение: в ткани ПЖ – очаги и поля роста мелкоацинарной аденокарциномы (3+3=6 баллов по шкале Глисона), в семенных пузырьках и семявыводящих протоках опухолевого роста нет.
В июле 2015 года пациент впервые отметил появление примеси крови в моче. В анализе крови уровень общего ПСА составляет 0 нг/мл, при УЗИ почек выявлено расширение чашечно-лоханочной системы справа до 2,5 см, при КТ с в/в контрастированием заподозрена обструкция правого мочеточника. В связи с чем пациент был госпитализирован в ГКБ им. Д.Д. Плетнева для проведения цистоскопии, уретероскопии справа.
Наследственный анамнез пациента не отягощен, из вредных привычек отмечает курение 2 пачек сигарет в неделю.
При осмотре: общее состояние пациента удовлетворительное, пальпация области почек безболезненная, симптом поколачивания отрицательный с обеих сторон, мочеиспускание учащено, при ректальном осмотре ПЖ не пальпируется, очагов уплотнения и флюктуации не выявлено, наружные половые органы не изменены. На момент поступления в стационар макрогематурии не отмечено.
В лабораторных данных обращало на себя внимание наличие соответствующих изменений в общем анализе мочи, цитологический анализ мочи был отрицателен, показатель ПСА – 0 нг/мл, остальные лабораторные исследования без отклонений.
5 августа 2015 года была произведена уретроцистоскопия, по данным которой наружный сфинктер уретры сохранен, вслед за сфинктером определяется зона уретроцистоанастомоза, имеющая адекватный просвет. При осмотре зоны анастомоза в режиме компьютерной хромоэндоскопии (Image 1S) патологических изменений подслизистого сосудистого рисунка не выявлено. При цистоскопии емкость мочевого пузыря 250 мл, слизистая не изменена как при осмотре в белом свете, так и в основных режимах spectra A и spectra B компьютерной хромоэндоскопии. Устья обоих мочеточников смещены к шейке мочевого пузыря, не сужены.
Учитывая, что при амбулаторном обследовании выявлена пиелокаликоэктазия справа, была произведена уретеропиелоскопия справа, при которой проксимальнее зоны перекреста с подвздошными сосудами выявлена одиночная папиллярная опухоль правого мочеточника размерами 1,5 х 1см (рис. 1). При фибропиелокаликоскопии выше опухоли изменений верхних мочевых путей не было выявлено. При уретероскопии в белом свете опухоль оказалась существенно меньше, чем в обоих основных режимах компьютерной хромоэндоскопии (1,5 см против 1 см в белом свете). Пациенту была произведена биопсия опухоли мочеточника в визуально усиленном режиме spectra A. Для получения большего объема материала нами использована нитиноловая корзинка, а не биопсийные щипцы (рис. 2). После проведения в почку страховой струны-проводника выполнена гольмиевая лазерная вапоризация правого мочеточника (2,2 дж. 12Гц, лазер «Auriga») (рис. 3, 4). При осмотре в режиме узкоспектровой эндоскопии (NBI) резидуальных образований и сателлитных опухолей не было выявлено. Почка была дренирована внутренним стентом 6 F. Гистологическое заключение: уротелиальная карцинома низкого риска (low grade) pT1G1N0M0.

Рис. 1. Уретероскопия. Вид опухоли
Fig. 1. The ureteroscopy. Ureteral tumor
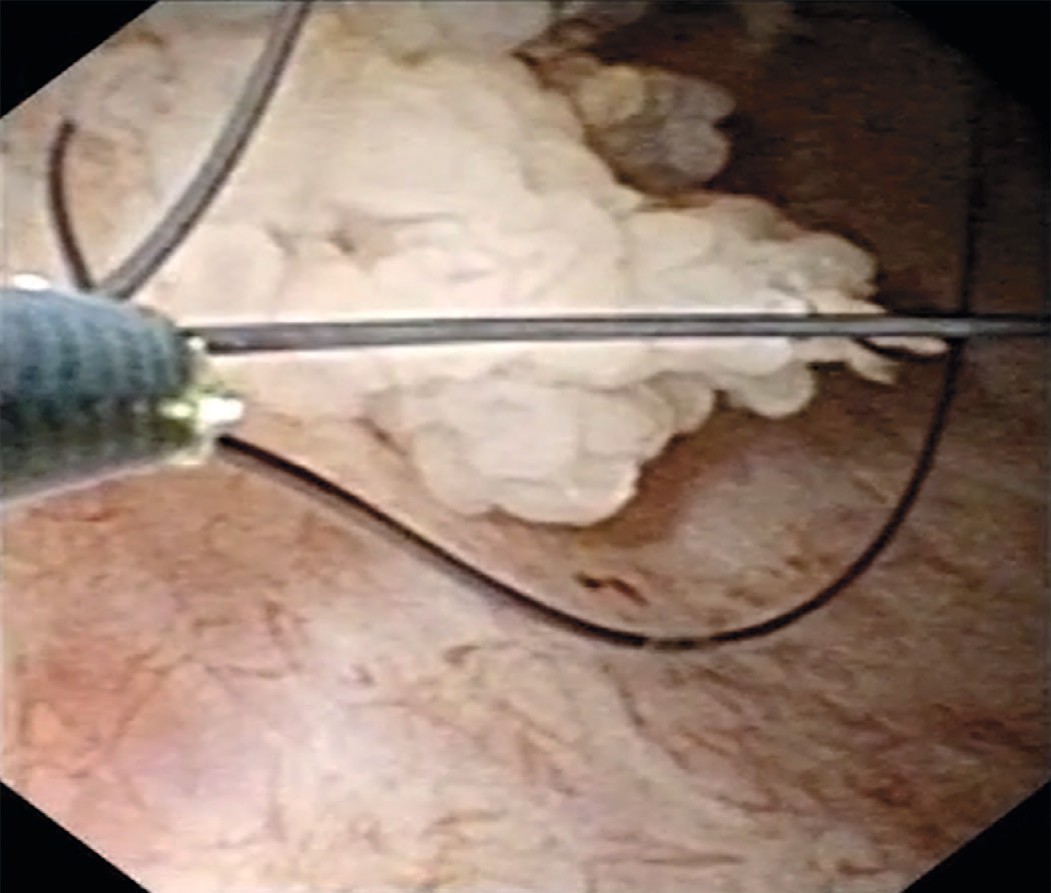
Рис. 2. Биопсия опухоли с помощью корзинки
Fig. 2. Basket biopsy of the tumor
Пациенту 8 октября 2015 года в нашей клинике выполнена цистоскопия, удаление внутреннего стента, контрольная уретеропиелоскопия с узкоспектровой диагностикой (NBI), при которой рецидива опухоли выявлено не было. Цитологический анализ мочи был отрицателен. При контрольных обследованиях в 2016-2020 гг. рецидива меланомы, рака ПЖ (PSA 0,001 нг/мл) и папиллярного рака верхних мочевых путей и мочевого пузыря выявлено не было, цитология мочи отрицательная.
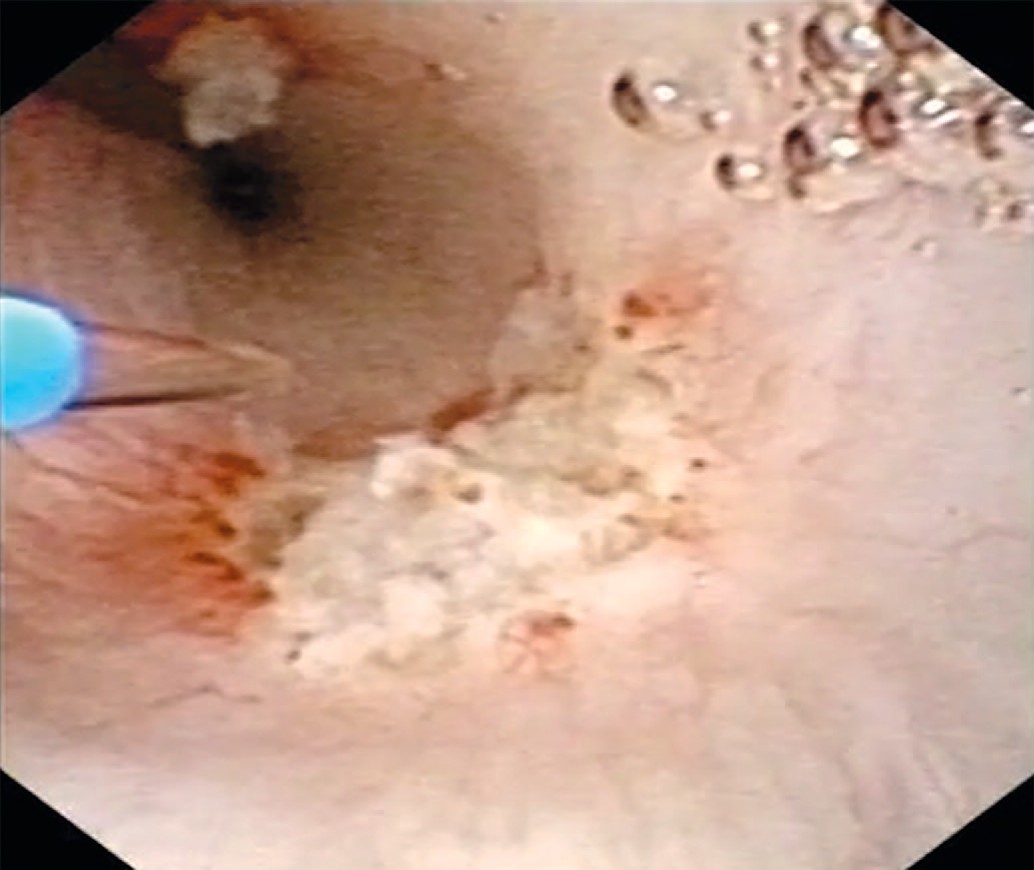
Рис. 3. Лазерная вапоризация опухоли мочеточника (режим белого света)
Fig. 3. Laser vaporization of the ureteral tumor (white light mode)
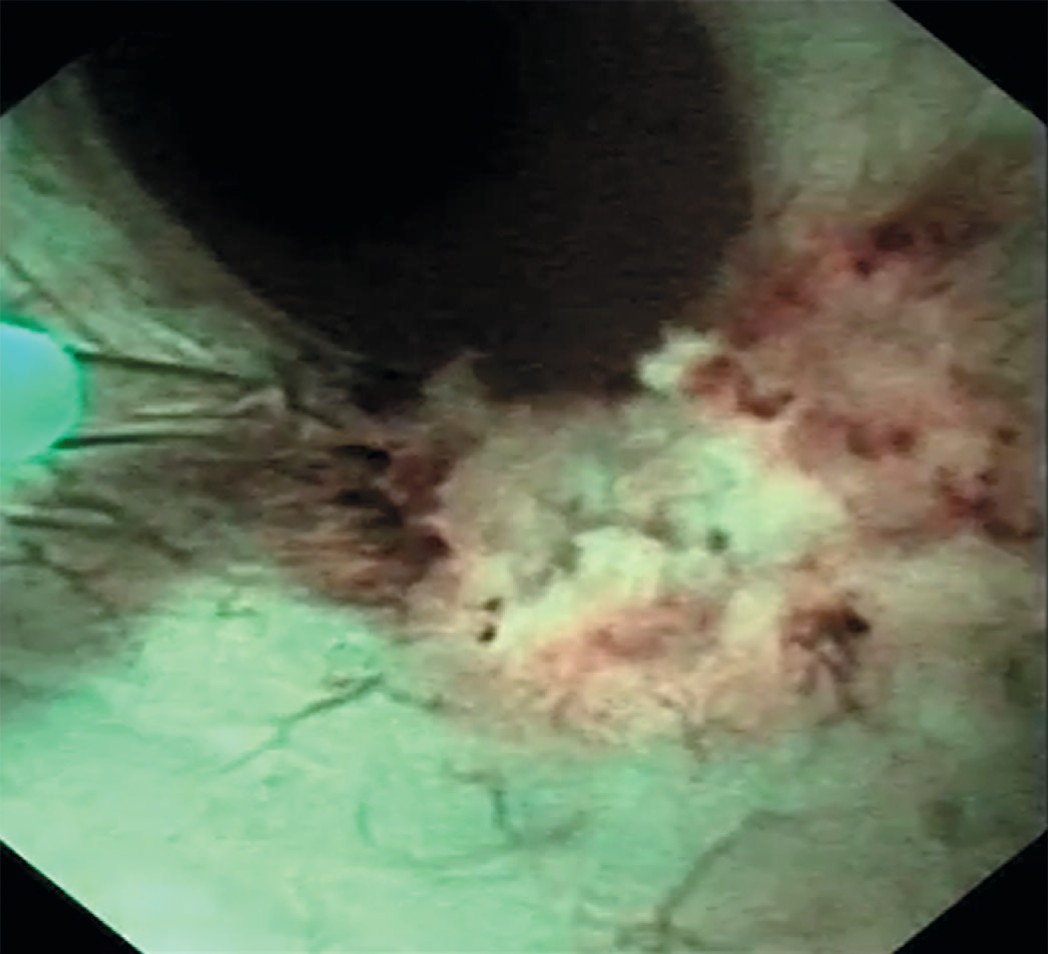
Рис. 4. Лазерная вапоризация опухоли мочеточника (режим узкоспектровой эндоскопии)
Fig. 4. Laser vaporization of the ureteral tumor (NBI – Narrow Band Image)
ОБСУЖДЕНИЕ КЛИНИЧЕСКОГО СЛУЧАЯ
Настоящее наблюдение интересно в связи с редким сочетанием у одного пациента трех онкологических заболеваний в течение сравнительно небольшого временного промежутка (21 месяц). Среди возможных причин развития подобного состояния можно рассматривать как нарушение экспрессии генов (р53 и других), что может служить универсальным звеном для развития новообразований. Среди других причин следует рассматривать нарушение противоопухолевого иммунитета, которое может происходить в результате воздействия наружных факторов (вредные факторы окружающей среды, облучение, системная химиотерапия) [5].
Показанием для проведения органосохраняющего лечения папиллярного рака у данного пациента явилось наличие одиночной папиллярной опухоли, удобной для ее эндоскопического удаления, при условии соблюдения пациентом режима контрольных обследований [6]. С другой стороны, наличие у пациента в анамнезе двух онкологических заболеваний (меланома кожи T1aN0M0, рак ПЖ T2сN0M0), каждое из которых может в будущем потребовать проведения системной химиотерапии, требует от врача органосберегающего подхода, так как нефроуретерэктомия с резекцией мочевого пузыря у подобного пациента может ухудшить суммарную азотовыделительную функцию почек [4].
Использование современных оптических и компьютерных технологий позволило нам не только провести раннюю диагностику папиллярного рака мочеточника, но и выполнить более радикальное удаление опухоли, так как границы вапоризации в белом свете и режиме spectra A компьютерной хромоэндоскопии отличались на 33%. Выполнение биопсии мочеточника позволило верифицировать опухоль и точно установить степень дифференцировки. Отсутствие морфологической верификации диагноза нередко является препятствием для последующего наблюдения и получения противорецидивного лечения у онколога, поэтому в данном случае и в большинстве других мы используем корзинку для получения достаточного количества биопсийного материала.
ВЫВОДЫ
Каждый случай первично-множественного рака является уникальным и, ввиду лимитированного количества клинических случаев, четкие алгоритмы лечения не разработаны. Представленный в статье клинический случай демонстрирует успешные результаты персонализированного подхода к лечению первично-множественных локализованных опухолей органов мочевыводящих путей с одним из наиболее длительных периодов наблюдения (5 лет). Для данной категории пациентов необходимо прецизионное динамическое наблюдение с применением современных визуализационных и инструментальных методов, что может обеспечить своевременное выявление и лечение рецидивов.
ЛИТЕРАТУРА
- Rouprêt M, Babjuk M, Compérat E, Zigeuner R, Sylvester R, Burger M, et al. European guidelines on upper tract urothelial carcinomas: 2013 update. Eur Urol 2013;63(6):1059-1071. https://doi.org/10.1016/j.eururo.2013.03.032.
- Мартов А.Г., Соломатников И.А., Байков Н.А., Андронов А.С., Халмурзаев О.А. Узкоспектровая диагностика и компьютерная хромоэндоскопия в диагностике папиллярных опухолей нижних и верхних мочевых путей. Урология 2015;(5):55-59. [Martov A.G., Solomatnikov I.A., Baykov N.A., Andronov A.S., Khalmurzaev O.A. Narrowed spectrum diagnostics and computer chromoendoscopy in the diagnosis of epithelial neoplasms of the lower and upper urinary tract. Urollogiya = Urology 2015;(5):55-59. (In Russian)]
- Rai BP, Shelley M, Coles B, Somani B, Nabi G. Surgical management for upper urinary tract transitional cell carcinoma (UUT-TCC): a systematic review. BJU Int 2012;110(10):1426–1435. https://doi.org/10.1111/j.1464-410X.2012.11341.x.
- Sonpavde G, Watson D, Tourtellott M, Cowey CL, Hellerstedt B, Hutson TE, et al. Administration of cisplatin-based chemotherapy for advanced urothelial carcinoma in the community. Clin Genitourin Cancer 2012;10(1):1–5. https://doi.org/10.1016/j.clgc.2011.11.005.
- Леонов О.В., Слонимская Е.М., Долгих В.Т. Опыт лечения больных с урологической полинеоплазией. Вопросы онкологии 2008;54(2):220-224. [Leonov O.V., Slonimskaya Ye.M., Dolgikh V.T. Treatment for urologic polyneoplasia. Voprosy onkologii =Problems in Оncology 2008;54(2):220-224. (In Russian)]
- Зуков Р. А., Дыхно Ю. А. Редкий случай урологический полинеоплазии. Сибирское медицинское обозрение 2009;(5):86-88. [Zukov R.A., Dihno U.A. Rare case of urological polyneoplasia. Sibirskoye meditsinskoye obozreniye = Siberian Medical Review 2009;(5):86-88. (In Russian)]







