В современной урологии до сих пор существует немало проблем, которые являются «ее темными лошадками» или своеобразными «камнями преткновения». Одной из таких проблем является симптом ночного мочеиспускания (ноктурия), который кажется большинству урологов достаточно понятным для того, чтобы предложить что-то новое. Однако, «старое» вовсе не означает «понятное». Симптом ноктурии до последнего времени не вызывал научно-практического интереса, т.к. урологам он казался вполне знакомым и понятным явлением, а в качестве его причин большинство врачей сразу называли доброкачественную гиперплазию предстательной железы (ДГПЖ). Сложилось впечатление, что других причин ноктурии не существует. Действительно, вопрос о патогенезе ноктурии ставит в тупик до сих пор, и еще двадцать лет назад на него было непросто ответить. Однако к настоящему времени накоплен революционный объем знаний, который позволяет совершенно по-иному посмотреть на этот известный всем симптом, и авторы данной статьи ставили своей целью донести до широкой врачебной аудитории новые теории и гипотезы возникновения ноктурии. Они связаны с гендерными особенностями ноктурии, которые практически не освещены в современной урологической отечественной литературе.
НОКТУРИЯ ИЛИ НИКТУРИЯ? ЭВОЛЮЦИЯ ПОНЯТИЙ И СОВРЕМЕННАЯ ТЕРМИНОЛОГИЯ
Длительное время патофизиология и нейрофизиология ночного мочеиспускания практически не изучалась. В отечественной урологической литературе мочеиспускание ночью традиционно обозначалось двумя терминами: «никтурия» и «ноктурия», при этом в эти термины вкладывались совершенно разные понятия [1-3]. Согласно учебнику «Урология» под ред. Лопаткина Н.А., по которому обучалось не одно поколение сначала советских, а затем и российских урологов, о никтурии следовало говорить в тех случаях, когда пациент вставал мочиться ночью в связи с увеличением ночного диуреза, причинами которого считались либо сердечно-сосудистая недостаточность, либо ранняя стадия хронической почечной недостаточности [3]. Ноктурия для российских урологов означала такое нарушение мочеиспускания, при котором пациент вынужден был вставать мочиться ночью из-за ирритативных симптомов, при этом однократный объем мочеиспускания был существенно меньше, чем при никтурии, что и служило главным дифференциально-диагностическим тестом для разграничения этих патологических состояний [3]. Ночное мочеиспускание как ранее, так и нередко сейчас ассоциируется в умах урологов, прежде всего, с ДГПЖ [1]. О ноктурии у женщин в учебниках по урологии вообще не упоминалось [1-3]. Таким образом, отсутствие на тот момент доказательных крупномасштабных исследований феномена ночного мочеиспускания отражалось и на взглядах урологов на эту проблему, о причинах возникновения которой мало что тогда знали, не говоря уже о методах терапии. Повышенный интерес к симптому ночных мочеиспусканий возник в конце 90-х годов XX века, когда появившиеся исследования (в том числе, ставшие «классикой жанра» уродинамические исследования (КУДИ) и суточный уродинамический мониторинг) показали клиническую неоднородность данной категории пациентов с точки зрения гендерной этиологии и патогенеза ночного мочеиспускания [4-8]. Это привело к необходимости пересмотра и стандартизации терминов. Поэтому в 2002 году Комитетом Международного общества по удержанию мочи (ICS) для обозначения симптома ночного мочеиспускания был предложен единый термин – ноктурия, под которой, согласно принятому определению, следует понимать необходимость вставать ночью один и более раз с целью опорожнения мочевого пузыря [9]. Появление нового термина привнесло определенный дискомфорт в привычный терминологический стереотип мышления большинства российских врачей, многие из которых стали понимать под этими терминами совершенно разные патофизиологические состояния [10-13]. Однако все дело в том, что ноктурия и никтурия являются синонимами: noctu (латинское) – ночь; nyctos (греческое) – ночь [13]. По мнению Вишневского Е.Л. и соавт. в окончательном виде термин «ноктурия» правильнее было бы использовать для обозначения мочеиспусканий ночью, а термин «никтурия» для обозначения повышенного мочеобразования в ночное время [13]. Но, согласно принятой большинством мировых урологов терминологии, для обозначения аномально повышенного ночного диуреза лучше использовать термин «ночная полиурия», которая, по современным представлениям, является одним из патогенетических механизмов ночного мочеиспускания, т.е., собственно ноктурии [13]. Таким образом, хотя в клинической практике для обозначения ночных мочеиспусканий сегодня используются и термин «ноктурия», и термин «никтурия» как равноправные, вкладывать в них нужно только один смысл – необходимость вставать мочиться ночью более одного раза. Поэтому для удобства стандартизации исследований, диагностических и терапевтических процедур предпочтительнее пользоваться термином «ноктурия» как наиболее правильным с точки зрения патофизиологии [9, 13].
НЕЙРОФИЗИОЛОГИЯ И НЕЙРОЭНДОКРИНОЛОГИЯ МОЧЕИСПУСКАНИЯ
Научные исследования акта мочеиспускания и симптомов нижних мочевых путей (СНМП) стали доступными только после того, как в клиническую практику были внедрены методы оценки функции нижних мочевых путей: урофлоуметрия, цистоманометрия и сфинктерометрия [14]. Долгое время эти исследования носили сравнительно механистический характер. Но в 1947 году Cifuentes, а затем в 1948 году Wassermann установили факт зависимости функции нижних мочевых путей у женщин от уровня эстрогенов [15-21]. С этого времени исследования нарушений мочеиспускания у женщин приобрели новое патогенетическое значение, позволившее к настоящему времени получить уникальные клинико-экспериментальные данные о закономерностях функционирования мочевого пузыря и уретры у женщин, в основе которых лежит принцип преимущественной эстроген-зависимости всех структур мочевых путей у женщин, аналогично тому, как у мужчин эти же структуры являются преимущественно андроген-зависимыми [1521]. Согласно классической концепции нейрофизиологии мочевого пузыря и уродинамики мочеиспускания, иннервация мочевого пузыря осуществляется посредством ЦНС и периферической (автономной) нервной системы [4]. Последняя участвует в контроле за мочеиспусканием посредством симпатической и парасимпатической иннервации. Клетки симпатической нервной системы располагаются в паравертебральных ганглиях T10–L2. Их нейроны затем подходят через подчревное сплетение к тазовым нервам. Указанные нервы контролируют у женщин процеccы накопления мочи в мочевом пузыре посредством воздействия медиатора норадреналина на три класса адренорецепторов – α-1, α-2 и b [4, 12]. α-1–адренорецепторы подразделяют на три подтипа: α-1A (ранее известный как α-1C), α-1B и α-1D. Четвертый подтип, известный как α-1L, характеризуется низким сродством к празозину (остальные подтипы имеют высокое сродство к празозину) и может представлять собой конформационный вариант адренорецептора α-1A [22]. α–адренорецепторы в значительном количестве сосредоточены в области шейки мочевого пузыря и проксимальной уретры, и их активность определяет тонус гладких мышц в этой области. Кроме того, подтип α-1D представлен в небольшом количестве в детрузоре [21]. Преобладающим типом адренорецепторов в детрузоре являются β-адренорецепторы, которые участвуют в его расслаблении (адаптации) и поддержании низкого внутрипузырного давления в фазу накопления [21, 22]. Важнейшими компонентами эффектов парасимпатической нервной системы на нижние мочевые пути являются мускариновые рецепторы (М-холинорецепторы), постганлионары которых работают на ацетилхолине и обеспечивают как трофику и метаболизм мочевого пузыря и уретры, так и синергические взаимодействия с адренергическими структурами, обеспечивая так называемое пластическое моделирование мочеиспускания, т.е. способность нижних мочевых путей нормально функционировать в любых условиях [21, 22]. В настоящее время идентифицировано 5 типов М-холинорецепторов, из которых М-1, М-2 и М-3 широко представлены в мочевом пузыре [4, 19, 21].
Модулировать функции нейрорецепторного аппарата мочевого пузыря как у женщин, так и у мужчин, способны половые гормоны. Эффекты эстрадиола у женщин осуществляются через его воздействие преимущественно на α-адренорецепторы, прогестерона – на β-адренорецепторы, соответственно [19]. Кроме того, в женской мочеполовой системе (клитор, парауретральные ткани, уретра, влагалище и матка) на основе экспериментальных исследований выявлена экспрессия гена ФДЭ-5 типа и NO-синтаз, основной функцией которых является участие в синтезе оксида азота (NO) и регуляции NO-зависимой вазодиатации, иннервации, метаболизма и энергетического обмена органов урогенитального тракта [20, 22, 23]. Слизистые оболочки, мышцы и сосуды влагалища, уретры, треугольника Льето и дна мочевого пузыря у женщин наряду с нейрорецепторным аппаратом содержат прогестероновые, эстрогеновые и андрогенные рецепторы, между которыми существует теснейшее функциональное взаимодействие. Большинство структур пузырно-уретрально-простатического комплекса у мужчин являются андроген-зависимыми, и участие оксида азота в их функционировании также объективно доказано [15-23] (рис. 1).
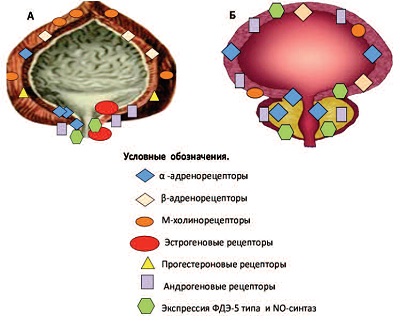
Рис. 1. Локализация рецепторов к половым гормонам в нижних мочевых путях у женщин (А) и мужчин (Б) [15-23]
Особенностями нейрорецепторного и гормонального аппарата объясняются механизмы действия половых гормонов на функцию нижних мочевых путей, которые сводятся к следующим:
- Регуляция активности NOсинтазы (кровоток, иннервация, кислородное обеспечение тканей, метаболизм и энергообмен).
- Эндотелий-зависимая вазодилятация (кровоток, иннервация).
- Эндотелий-независимая нейронально-опосредованная вазодилятация (кровоток).
- Обеспечение тонуса и трофики мышечных элементов детрузора («мышечный» каркас и тонус мочевого пузыря, уретры, предстательной железы).
- Синтез коллагена и эластина в связочном аппарате (коллагеновый статус урогенитального тракта).
- Функциональное состояние уротелия (муцин, полисахариды, предкоитальное увлажнение и т.д.).
- Местный иммунитет (бактерицидный эффект мочи, секрета предстательной железы, гликополисахариды слизистой, Ig A,IgM) [15-23].
Последствия дефицита половых гормонов для нижних мочевых путей хорошо известны и проявляются следующими негативными структурно-функциональными изменениям в них:
- Снижение кровообращения в органах малого таза, в том числе, за счет индукции тазового атеросклероза, что приводит к гипоксии и ишемии органов мочеполовой системы (дефицит вазодилатации – ишемическая болезнь органов малого таза и урогенитального тракта).
- Уменьшение диаметра артерий мочевого пузыря, снижение количества мелких сосудов и истончение их стенки (уменьшение плотности микроциркуляторного русла).
- Уменьшение диаметра вен в венозных сплетениях влагалища у женщин и предстательной железы у мужчин, а также в шейке мочевого пузыря и венозных сплетениях малого таза (хроническая венозная недостаточность – венозная и секреторная конгестия).
- Анатомо-функциональные нейропатические нарушения в урогенитальном тракте.
- Нарушение функции тазовых органов в силу выше описанных механизмов манифестирует различными клиническими масками урогенитальной дисфункции, одной из которых может быть ночное мочеиспускание [15-17, 19,20].
Принято считать, что возрастные нарушения мочеиспускания у женщин могут быть объяснены усугубляющимся дефицитом женских половых гормонов [16, 17]. Однако, клиническая картина климактерического синдрома характеризуется широкой вариабельностью проявлений, поэтому не все урогенитальные расстройства в перименопаузе и менопаузе могут быть объяснены недостаточным эффектом эстрогенов. В патогенезе ноктурии у женщин одно из ключевых мест занимает дефицит андрогенов. Тема андрогенного дефицита у женщин – новая и сложная. С одной стороны, некоторые симптомы дефицита андрогенов могут быть схожи с симптомами дефицита эстрогенов, поэтому об андрогенной недостаточности у женщин принято говорить только при адекватном уровне эстрогенов. C другой стороны существуют определенные проблемы в лабораторной диагностике андрогенного дефицита, которые в последнее время успешно решаются в связи с появлением максимально точного метода определения тестостерона – массспектрального анализа, доступного уже в рутинной практике [19]. Недавние исследования показывают, что ноктурия чаще встречается у женщин с изолированным дефицитом андрогенов или со смешанной формой гормональных нарушений (одновременный дефицит эстрогенов и андрогенов) [19].
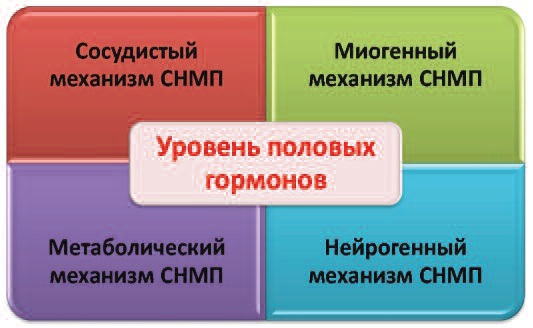
Рис. 2. Взаимоотношения основных патогенетических механизмов СНМП у обоих полов [20, 21]
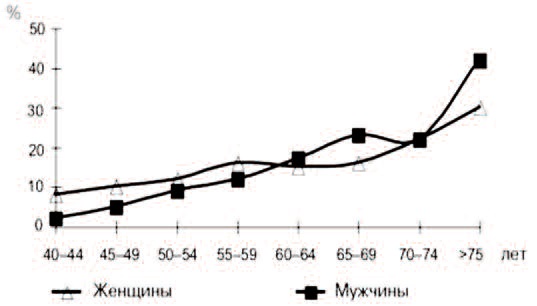
Рис. 3. Распространенность ноктурии у обоих полов в различном возрасте мужчин и женщин [26, 27]
Очевидно, что ряд эффектов на нижние мочевые пути у женщин опосредован именно андрогенами (синтез которых происходит в строме яичников и надпочечниках), а факт установленной экспрессии гена ФДЭ-5 типа в нижних мочевых путях может быть базовым патофизиологическим доказательством данного эффекта андрогенов у женщин [19, 22, 23]. Вероятно, с этим также связана неэффективность в целом ряде случаев стандартной эстрогенозаместительной терапии у женщин в менопаузе, которая достаточно эффективно нивелирует различные клинические проявления климакса, но не ликвидирует андроген-зависимые СНМП/ноктурию у них [19]. Можно с высокой долей вероятности констатировать, что в основе большинства анатомо-функциональных нарушений мочеиспускания лежат непосредственные или косвенные нарушения модуляции гормональной регуляции структур нижних мочевых путей, которые через целый ряд патофизиологических механизмов (нейрорецепторных, сосудистых, метаболических, миогенных) заканчиваются клинической манифестацией СНМП у обоих полов [20, 21] (рис. 2)
СОВРЕМЕННАЯ ГЕНДЕРНАЯ ЭПИДЕМИОЛОГИЯ НОКТУРИИ И ЕЕ ВЛИЯНИЕ НА КАЧЕСТВО ЖИЗНИ
Ноктурия – один из наиболее тягостных и склонных к прогрессированию СНМП как у мужчин, так и женщин, который, в отличие от классических представлений, может наблюдаться в любом возрасте [13]. Именно возраст, а не гендерные особенности, является независимым фактором риска развития любых СНМП, включая ноктурию, так как, согласно большинству современных эпидемиологических исследований, с возрастом частота ноктурии статистически достоверно и линейно возрастает у представителей обоих полов [24-26]. При этом именно выраженность ноктурии оказывает наиболее негативное влияние на качество жизни по сравнению с выраженностью дневных СНМП [25]. По данным Jackson S. ноктурия встречается у 10% пациентов обоего пола в возрасте до 40 лет и у более чем 80% пациентов старше 80 лет [8]. Аналогичная тенденция и в отношении увеличения частоты и выраженности ноктурии проявляется и у женщин [8, 10, 11, 26, 27] (рис. 3).
Проблемы эндокринологической урологии у женщин стали активно изучаться только в XX веке после установления факта эстрогензависимости всех структурных элементов нижних мочевых путей, а также в связи с демографическими изменениями в популяции женщин в целом [16]. До этого, в XIX и начале XX веков средняя продолжительность жизни женщины была меньше срока наступления менопаузы, то есть большинство женщин просто не доживало до того момента, когда развивались симптомы возрастного эстрогенного дефицита. Соответственно, проблемы коррекции менопаузальных расстройств у медиков того времени просто не существовало. Однако продолжительность жизни увеличивалась, и на рубеже XIX-XX веков она превысила средний возраст наступления менопаузы. В XX веке продолжительность жизни женщин также прогрессивно увеличивалась, поэтому к концу XX столетия женщина уже почти треть жизни проводила в состоянии эстрогенного дефицита. О высокой частоте ноктурии в изолированном виде и в рамках симптомокомплекса гиперактивного мочевого пузыря (ГМП) свидетельствуют результаты исследования National Overactive Bladder Evaluation (NOBLE), проведенного в 2001 году в США и основанного на телефонном опросе 5204 респондентов старше 18 лет [28]. В ходе исследования симптомы ГАМП выявлены у 16,9% опрошенных женщин и 16,0% мужчин, причем, их распространенность возрастала с возрастом опрошенных [28]. В США ГМП является одним из самых распространенных хронических заболеваний, т.к. показатели его распространенности (16-17%) сравнимы с показателями сахарного диабета (6%) и депрессии (20%) [28-31]. Негативное влияние любых СНМП у обоих полов на качество жизни, по данным ряда исследований, существенно более выражено, чем, например, влияние сахарного диабета 2 типа или артериальной гипертензии [28,29]. Ноктурия у людей пожилого и старческого возраста ассоциирована с другими тяжелыми последствиями для здоровья (инфекции мочевых путей, падения ночью, переломы), а также с выраженными нарушениями сна и депрессиями, что неблагоприятно сказывается на функционировании всех органов и систем [18, 30, 32,33]. Любая ноктурия связана с прерыванием или недостаточностью ночного сна и синдромом ночного апноэ, последствия которых могут быть достаточно серьезными и даже смертельными для пожилого пациента [6,34,35,36] (табл. 1).
Таблица 1. Последствия прерывания и/или лишения сна в связи с ноктурией [6]
| Ближайшие последствия | Отдаленные последствия |
|---|---|
| • Повышенная сонливость и уменьшение активности в дневное время • Увеличение времени реакции • Уменьшение энергии в дневное время • Снижение психомоторной активности • Ослабление концентрации, внимания и познавательной функции • Плохое настроение |
• Депрессии • Развитие инсулинорезистентности и сахарного диабета 2 типа • Более быстрое прогрессирование возрастного андрогенного дефицита • Подверженность соматическим заболеваниям • Повышенный риск сердечно-сосудистых заболеваний • Повышенный риск дорожно-транспортных происшествий • Повышенная частота падений и переломов • Помещение в дом престарелых • Смерть |
СОВРЕМЕННАЯ КОНЦЕПЦИЯ ПАТОГЕНЕЗА НОКТУРИИ
В последние годы ноктурия обсуждается как самостоятельная медико-социальная проблема, а не только как симптом исключительно ДГПЖ [13, 20, 24-35, 37]. В нашей стране огромную роль в реализации нового научного понимания ноктурии и популяризации этих научных взглядов сыграл выдающийся российский уролог профессор Е.Л. Вишневский [13]. В XXI веке уже накоплено достаточно данных для утверждения, что ноктурия является неспецифическим маркером инволюционных и метаболических нарушений в мочевой системе – старения, и поэтому одинаково часто наблюдается и прогрессирует у обоих полов в прямой связи с возрастом и имеет гораздо большее диагностическое и прогностическое значение, чем то, которое ей придается большинством врачей даже сегодня [13,20]. Появление ноктурии у пациента и пациентки молодого или среднего возраста свидетельствует об их раннем гормонально-метаболическом неблагополучии и нарушениях энергетического обеспечения и метаболизма органов мочевой системы (прежде всего, мочевого пузыря). Согласно теории старения В.И. Дильмана, именно возрастное снижение уровня гормонов (прежде всего, половых стероидов) ведет к накоплению свободных радикалов и усилению клеточного апоптоза, что неизбежно сопровождается появлением атрибутов старения [38]. Одним из таких атрибутов старения являются различные нарушения в мочевой системе, которые клинические проявляются СНМП и ноктурией [13, 37].
Для описания частоты мочеиспускания в специальной литературе используется термин «ритм суточных спонтанных мочеиспусканий» – это количество самостоятельных мочеиспусканий в течение суток, не вызывающих нарушения качества жизни. Согласно ICS, в норме здоровый человек мочится не более 6 раз в сутки при условии 6-часового ночного сна [9]. Это означает, что в дневное время здоровый человек мочится в среднем каждые 2-3 часа, а в течение ночи он не должен вставать мочиться как минимум в течение 67 часов сна. Такой ритм нормального суточного мочеиспускания обеспечивается динамическим равновесием между процессами мочеобразования в почках и процессами накопления и удержания мочи здоровым мочевым пузырем с хорошим потенциалом эластичности и пластичности (а, значит, с хорошими кровообращением, иннервацией и мышечным тонусом), что позволяет ему в норме за ночь удерживать объем мочи, эквивалентный не менее двум физиологическим объемам мочи при естественном дневном мочеиспускании. Функция мочевого пузыря в норме обеспечивается эластическими свойствами детрузора, которые зависят от интенсивности мочепузырного кровообращения, сохранности детрузорной и сфинктерной иннервации, а также его пластичностью (коллагеновый статус), которые являются у женщин, как и у мужчин, гормонозависимыми параметрами [39-40]. Функциональный конфликт между объемом суточного диуреза и резервуарной емкостью мочевого пузыря приводит к тому, что даже небольшой (менее физиологического) объем мочи в мочевом пузыре способен вызвать позыв к мочеиспусканию независимо от времени суток – так развивается симптом дневного учащения мочеиспускания, который при повышенном питьевом режиме называется дневной полиурией и рассматривается как физиологическое явление, а при нормальном дневном диурезе получает название поллакиурия и рассматривается как патологический СНМП, свидетельствующий о нарушении резервуарной функции мочевого пузыря [19, 20, 43-46]. Однако, в клинической практике очень часто у пациентов при опросе выявляется нормальный ритм дневных спонтанных мочеиспусканий на фоне нормального питьевого режима, но они предъявляют жалобы исключительно на необходимость вставать мочиться в ночное время (изолированную ноктурию). Согласно мнению Е.Л. Вишневского и соавт., в данном случае совершенно очевидно, что если в дневное время эластические и пластические свойства детрузора мочевого пузыря обеспечивают 2-3-часовой интервал между мочеиспусканиями, то в условиях ночного сна этого не происходит.
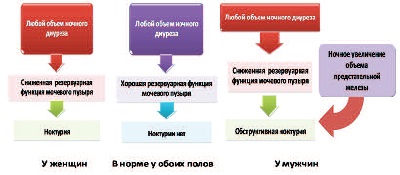
Рис. 4. Функционирование мочевой системы в ночное время в норме и при ноктурии у мужчин и женщин [13]
Таким образом, мы подходим к современному патогенезу ночного мочеиспускания, в котором можно выделить центральный конфликт между двумя функциональными системами – процессами мочеобразования в ночное время (ночная полиурия) и неудовлетворительным состоянием резервуарной функции мочевого пузыря (снижением его эластичности) [13]. Эти две закономерности объясняют патогенез ноктурии у обоих полов [13]. При этом у мужчин добавляется еще один мало известный феномен со стороны предстательной железы – относительное увеличение ее размеров ночью на 10-33% за счет простатостаза и венозной конгестии по сравнению с ее дневным объемом.
Таким образом, у мужчин, добавляется третий механизм ноктурии – обструктивное ночное мочеиспускание, или обструктивная ноктурия [13] (рис. 4).
НОЧНАЯ ПОЛИУРИЯ – ПЕРВЫЙ КЛЮЧЕВОЙ ФАКТОР ПАТОГЕНЕЗА НОКТУРИИ У ОБОИХ ПОЛОВ
Процесс образования мочи в почках (диурез) зависит от целого ряда факторов, среди которых возраст и ассоциированные с ним нарушения функции почек играют одну из ведущих ролей. Достоверно доказано, что независимо от наличия или отсутствия любых заболеваний почек с возрастом происходит снижение скорости клубочковой фильтрации в почках с одновременной тенденцией к нарушению их концентрационной функции, что сопровождается выделением изоили гипоосмолярной мочи и увеличением диуреза, что можно рассматривать как процесс старения ткани почек [43,44,45]. С возрастом происходят инволютивные изменения не только в почках, но и регулирующих их гормональных системах, среди которых наиболее клинически важными являются возрастные изменения в гипоталамо-гипофизарной системе, так как антидиуретический гормон (АДГ), или вазопрессин, синтезируемый в гипофизе, является основным регулятором почечной секреции и реабсорбции воды. Уровень АДГ (вазопрессина) при старении уменьшается, что ведет к повышению ночного диуреза (к появлению ночной полиурии – избыточного мочеобразования в ночные часы). Одновременно уровень мелатонина – гормона сна, секретируемого эпифизом, с возрастом также уменьшается, и меланопауза является одним из атрибутов гормонального старения, ведущая к возрастным нарушениям сна (инсомнии). Вот почему между ноктурией и возрастной бессонницей прослеживается прямая патогенетическая связь [32-35,46]. Итогом влияния этих и еще целого ряда других факторов на процессы мочеобразования в почках являются особенности продукции мочи в ночное время, которые лежат в основе ночной полиурии:
- Чем старше человек, тем больше он выделяет мочи в ночное время.
- После 50 лет количество мочи ночью удваивается – это неизбежный атрибут старения.
- Для возрастных нарушений диуреза характерны его индивидуальные параметры [13] (табл. 2).
Таблица 2. Основные причины ночной полиурии (ICS, 2002) [6]
| Диурез |
|---|
| Циркадные нарушения секреции
эффектов антидиуретического
гормона (АДГ): • Первичные (идиопатические) • Вторичные (избыточное потребление жидкости, кофеина, алкоголя в вечернее время) |
| Растворенные вещества /диурез |
| • Застойная сердечная недостаточность • Вегетативная дисфункция • Синдром апноэ во сне • Почечная недостаточность • Недостаточность половых гормонов |
По мнению Е.Л. Вишневского и соавт., ночная полиурия является одним из ключевых факторов патогенеза ноктурии у обоих полов [13]. Они же предложили выделять два типа ночной полиурии: возрастную и абсолютную [13]. При возрастной ночной полиурии увеличение ночного диуреза не является плавным статистически достоверные различия наблюдаются только относительно 50-летнего рубежа. По достижении указанного возраста происходит как бы «скачкообразное» его увеличение. Возрастной рубеж и полиурический эффект, по мнению Е.Л. Вишневского и соавт., вполне определены – после 50 лет количество вытекающими из этого обстоятельства последствиями для диуреза [13]. О возрастной ночной полиурии говорят, если за стандартное время ночного сна (8 ч) диурез превышает не более, чем на 33-35% суточный диурез здорового человека до 50 лет без клинических СНМП (что составляет в среднем > 0,9 мл/мин) [34, 45]. О полиурической (абсолютной) форме ночной полиурии говорят, если ночной диурез в любом возрасте за 8 часов сна превышает средневозрастные показатели здорового человека без СНМП более, чем на 35% [11, 26]. Деление ночной полиурии на выше описанные типы имеет большое клиническое значение: если в первом случае не требуется проведения специальных исследований, то при втором – показано расширение диагностической программы для выявления ее вероятных причин, так как в данном случае увеличение ночного диуреза не может быть объяснено одним лишь возрастным фактором [13].
Таким образом, в своей клинической практике уролог встречается только с небольшой группой возможных причин ночной полиурии. Поэтому, приступая к обследованию, урологу следует иметь в виду, что существует большая группа экстрауринарных причин ночной полиурии, которые могут действовать отдельно или в сочетании друг с другом. «Списывание» ночной полиурии и, соответственно, ноктурии у пациента только на возраст и отказ от дальнейших диагностических поисков причин указанных нарушений является в корне неверным и даже вредным. Такой подход уводит врача от выявления причин, являющихся прямой или косвенной угрозой жизни пациента (например, ночная полиурия как маркер сердечной недостаточности, дефицита половых гормонов или сахарного диабета 2 типа), клиническим маркером которых служат ночные нарушения диуреза и мочеиспускания. По мнению Е.Л. Вишневского и соавт., подсчет суточного и ночного диуреза являются простыми, но вполне надежными методами оценки наличия и выраженности ночной полиурии, и должны применяться во всех случаях при наличии жалоб больного на ноктурию для дифференциальной диагностики возрастного и абсолютного типов ночной полиурии [13]. Для клинического проявления симптома ноктурии, кроме функциональной перегрузки мочевых путей увеличенным объемом образующейся в почках мочи, необходимо еще одно условие: нарушение адаптационных механизмов мочевого пузыря к этим повышенным функциональным потребностям.
НАРУШЕНИЯ РЕЗЕРВУАРНОЙ ФУНКЦИИ МОЧЕВОГО ПУЗЫРЯ – ВТОРОЙ КЛЮЧЕВОЙ ФАКТОР ПАТОГЕНЕЗА НОКТУРИИ У ОБОИХ ПОЛОВ
Ноктурия развивается и усугубляется в связи с процессами физиологического и гормонального старения человека независимо от гендерных особенностей (рис. 5). Основные причины нарушения резервуарной функции мочевого пузыря:
- Любая нейропатия мочевого пузыря (метаболическая, посттравматическая, ятрогенная, ишемическая, токсическая), ведет к повышенной активности детрузора (ГАМП, детрузорно-сфинктерная диссинергия) [47].
- Ожирение и метаболический синдром [48,49, 50-56].
- Инсулинорезистентность и сахарный диабет [48-56].
- Тазовый атеросклероз в изолированном виде или ассоциированный с метаболическим синдромом [55, 56].
- Дефицит половых гормонов, ведущий к нарушению синтеза оксида азота NO и NO-зависимой вазодилатации у женщин, дефициту кровообращения и иннервации, индукции и поддержанию нейропатии и детрузорной ишемии [57-60]. В наших исследованиях показано, что выраженность ноктурии напрямую зависит от уровня общего тестостерона крови у мужчин [20].
- Дизэлектролитемия в изолированном виде или как следствие хронической почечной недостаточности (синдром «периодических движений ног во сне», синдром «беспокойных ног») [47].
- Хроническая обструктивная болезнь легких [47].
- Заболевания сердечно-сосудистой системы [47].
- Неврологические заболевания (опухоли головного мозга: 2430% у взрослых и до 71% при глиомах моста мозга у детей; болезнь Паркинсона: 38-70% больных, у мужчин на 10-15% реже, чем у женщин; болезнь Альцгеймера: частота 23-48%: эпилепсия, травмы головного и спинного мозга, задержка умственного развития: у 12-65% больных; церебральный паралич: 30-40% больных; рассеянный склероз: 50-90% больных; нарушения мозгового кровообращения: 28-50% больных) [47].
- Синдром «сморщенного мочевого пузыря» (туберкулез, шистосомоз, бильгарциоз, интерстициальный цистит, травмы мочевого пузыря, спинного мозга и костей таза: 90-97% больных, стеноз спинномозгового канала и последствия операций на позвоночнике: 50-62%) [47].
- Злоупотребление алкоголем: у 15-65% больных [47].
- Опоясывающий и генитальный герпес: у 28% больных [47].
- Порфирия: у 12% больных[47].
- ВИЧ: у 12% больных [47].
- Ятрогенные нарушения: брюшнопромежностная экстирпация прямой кишки – у 50%, радикальная простатэктомия – у 15-20% [47].

Рис. 5. Схема патогенеза нарушения резервуарной функции мочевого пузыря в процессе физиологического старения [12, 13]
Мы полагаем, что с учетом гормонозависимости всех структур нижних мочевых путей как у мужчин, так и женщин, любые СНМП, в том числе, ноктурия, должны рассматриваться, прежде всего, с позиций возрастного или индивидуального дефицита половых гормонов у обоих полов, который возникает и прогрессирует с возрастом, аналогично тому, как с возрастом возникают и прогрессируют большинство соматических и эндокринных заболеваний человека, включая урологические. Эта концепция находится в точном и логичном соот-ветствии с приведенными выше новыми данными о патогенезе ночного мочеиспускания.
КЛИНИЧЕСКОЕ ЗНАЧЕНИЕ НОКТУРИИ И ОСОБЕННОСТИ ЕЕ СОВРЕМЕННОЙ ПАТОГЕНЕТИЧЕСКОЙ ДИАГНОСТИКИ
Симптом ноктурии долгое время традиционно связывался в урологической литературе практически лишь с заболеваниями предстательной железы, поэтому в виду того, что он включен в перечень симптомов Международной шкалы оценки симптомов, связанных с заболеваниями предстательной железы (IPSS-QL), большинство практикующих урологов по-прежнему трактуют его исключительно как профильный симптом ДГПЖ. Однако сегодня ноктурия рассматривается как маркер системных гормонально-метаболических нарушений, точкой приложения которых является пузырно-простатический комплекс. Только такой междисциплинарный подход к «старой» проблеме способен перевернуть наше традиционное представление о диагностическом и прогностическом значении симптома ноктурии для клинической практики. Ноктурия не просто один из неприятнейших СНМП, существенно снижающий качество жизни пациента в любом возрасте. Данные литературы и собственные клинические наблюдения показывают, что наличие и степень выраженности ноктурии в любом возрасте являются маркерами нарушений метаболизма детрузора мочевого пузыря, и несут в себе гораздо большее диагностическое и прогностическое значение, чем то, которое им придается в настоящее время в клинической урологической практике [19,20].
Являясь ранним клиническим проявлением нарушений функций гормоно-зависимых структур почек и нижних мочевых путей (кровообращения, иннервации, силы и тонуса детрузора и сфинктерного аппарата, эластичности и растяжимости стенки мочевого пузыря), ноктурия должна рассматриваться как ранний урологический маркер гормональнометаболических нарушений у обоих полов, ассоциированных с возрастом и возраст-ассоциированными заболеваниями. Мы считаем, что в этом смысле диагностическое значение ноктурии соответствует нашему сегодняшнему пониманию значения эректильной дисфункции как барометра гормонального и сосудистого здоровья мужчины, поскольку в основе нарушений эрекции и мочеиспускания лежат одни и те же патофизиологические механизмы, являющиеся факторами риска обоих заболеваний (ожирение, инсулинорезистентность, сахарный диабет, дефицит половых гормонов, дислипидемия, эндотелиальная дисфункция, депрессии, артериальная гипертензия и т.д.) [20]. Любое клиническое обследование у врача любой специальности требует активного выявления ноктурии. Это крайне просто – задать пациенту вопрос имеются или нет у него (нее) ночные мочеиспускания. Выявленный симптом ночного мочеиспускания всегда требует комплексной патогенетической диагностики с целью уточнения возможных причин и планирования патогенетического лечения во всех случаях.
При обследовании пациентов в любом возрасте ноктурию всегда необходимо выявлять активно, так как многие из них ночное мочеиспускание рассматривают как «возрастную норму» и жалоб самостоятельно не предъявляют. Активно следует выявлять симптомы нарушений сна, депрессии, признаки андрогенного дефицита и сердечно-сосудистых заболеваний, с которыми патогенетически связана ноктурия.
В рамках диагностики ноктурии у больных с ожирением и метаболическим синдромом следует предполагать весь рекомендованный при данной патологии спектр биохимических и гормональных исследований, активно выявляя ожирение (измерение окружности талии), кожные маркеры инсулинорезистентности и андрогенного дефицита, которые тесно связаны между собой общими патогенетическими механизмами.
Ценную информацию о состоянии мочепузырного кровотока и тазовых вен можно получить с помощью трансвагинального или трансректального УЗ-допплерографического исследования, которое на практике, к сожалению, выполняется редко. Выявление венозной недостаточности малого таза может быть маркером дефицита половых гормонов у обоих полов. При наличии неврологической патологии полезным будет консультация врача-невролога.
Лабораторный этап диагностики ноктурии включает в себя биохимические и гормональные исследования. К традиционно назначаемым урологами клиническим анализам мочи, пробам Нечипоренко и Зимницкого (почечные пробы) всем пациентам с ноктурией следует обязательно проводить определение в крови уровня креатинина, мочевой кислоты, холестерина и липидного спектра, глюкозы крови, а также половых гормонов (эстрадиол, общий тестостерон), пролактина, ТТГ, инсулина, С-пептида. При выявлении гормональных нарушений к лечению должен быть привлечен эндокринолог или гинеколог-эндокринолог.
Специализированный этап урологического обследования обязательно должен включать уродинамическое и (по показаниям) эндоскопическое исследования нижних мочевых путей. Только в ходе максимально полного и комплексного обследования можно выявить все возможные механизмы ноктурии у конкретного пациента и назначить не симптоматическое, а патогенетическое лечение, которое приведет к полному излечению пациента, купированию ноктурии как маркера другого заболевания, а не создаст видимость улучшения симптоматики. Мы считаем, что ноктурия, как и эректильная дисфункция – это ранние урологические маркеры гормонально-метаболического дисбаланса, в основе которых лежит универсальный механизм эндотелиальной дисфункции, поражающей терминальные нервно-мышечные элементы урогенитального тракта гораздо раньше, чем традиционные кардиологические симптомы. Наличие ноктурии всегда требует комплексной диагностики и патогенетического лечения.
ЗАКЛЮЧЕНИЕ
Принципы доказательной и патогенетической медицины XXI века требуют от врачей междисциплинарных взаимодействий, в рамках которых возможно профессиональное движение вперед. Старые представления о, казалось бы, известных симптомах, должны быть сегодня отброшены в сторону, так как характерные для них костность и консерватизм уже являются серьезным препятствием для того, чтобы наши пациенты получили правильное патогенетическое лечение всех заболеваний. Представления о ноктурии в старом формате не соответствуют требованиям времени. Этот симптом является уникальным маркером возрастных гормонально-ассоциированных изменений в организме. Поэтому рассматривать ноктурию и осуществлять ее рациональную диагностику и патогенетическую терапию сегодня необходимо с позиций полиэтиологичности и мультифакторности патогенеза ночного мочеиспускания у обоих полов.
Резюме:
В обзорной статье с гендерной точки зрения рассматриваются современные эпидемиологические особенности и патофизиологические механизмы ночного мочеиспускания (ноктурии), основанные на результатах современных исследований в данной области и собственных клинических данных.
Результаты эпидемиологических исследований показывают, что ноктурия является универсальным возрастным феноменом, лишенным гендерной окраски, а не только симптомом, характерным для мужчин с доброкачественной гиперплазией предстательной железы. Показана тесная патогенетическая связь ноктурии с возрастными гормонально-метаболическими нарушениями, приводящими к появлению ночной полиурии и снижению резервуарной емкости мочевого пузыря как двух кардинальных факторов ноктурии у обоих полов. Кроме того, описан третий фактор патогенеза ноктурии, характерный только для мужчин – обструктивное ночное мочеиспускание, которое является гендерной спецификой ноктурии у больных мужского пола. Высказана мысль о том, что ноктурия у обоих полов, наряду с эректильной дисфункцией у мужчин является ранним урологическим маркером нарушений функций гормонозависимых структур почек и нижних мочевых путей, ассоциированных с возрастом и возраст-ассоциированными заболеваниями. Патофизиологической основой ноктурии у обоих полов является гормоно-зависимая эндотелиальная дисфункция, поражающая терминальные нервно-мышечные элементы урогенитального тракта гораздо раньше, чем появляются традиционные кардиологические симптомы.
Поэтому настоятельным требованием современной медицины является активное раннее выявление ноктурии, а при ее наличии комплексная диагностика, позволяющая определить основное заболевание, ранним клиническим маркером которого и является ночное мочеиспускание.
Поэтому настоятельным требованием современной медицины является активное раннее выявление ноктурии, а при ее наличии комплексная диагностика, позволяющая определить основное заболевание, ранним клиническим маркером которого и является ночное мочеиспускание.
ЛИТЕРАТУРА
1. Пытель Ю.А. Погорелко И.П. Основы практической урологии. М.: Медицина, 1969. 329 с.
2. Пытель А.Я., Гришин М.А. Заболевания единственной почки. М.: Медицина, 1973. 184 с.
3. Урология. / Учебник для медицинских ВУЗов [Под ред. Лопаткина Н.А.]. М.: Медицина, 1982.
4. Weiss JP, Stember DS, Blavias JG. Nocturia in adults: classification. // Neurourol. Urodyn. 1997. Vol. 16. № 5. Р. 401.
5. Weiss JP, Blavias JG. Nocturia. // J Urol. 2000. VOL. 163. Р. 5-12.
6. Abrams P. Nocturia: the major problem in patients with LUTS suggestive of BPO. // Eur. Urol. 2005. Vol. 3. № 6. Р. 8-16.
7. Lye M. Rhythm of life and vicissitudes of old age. // Lancet. 1999. Vol. 353. № 1. Р. 1461.
8. Jackson S. LUTS and nocturia in men and women: prevalence, aethiology and diagnosis. // Br. J. Urol. Int. 1999. Vol. 84. Р. 5-8.
9. Van Kerrebroeck P, Abrams P, Chaikin D. The standartization of terminology in nocturia: report from the standartization subcommittee of the International Continence Society/ // Br. J. Urol. Int. 2002. Vol. 90. Р. 11-15.
10. Van Dijk L, Kooij DG, Schelevis FG. Nocturia in Dutch adult population. // Br. J. Urol Int. 2002. Vol. 90. Р. 644-648.
11. Weiss JP, Blavias JG. Nocturia. // Curr Urol Rep. 2003. Vol. 4. № 5. Р. 362-366.
12. Вишневский Е.Л., Лоран О.Б., Вишневский А.Е. Клиническая оценка расстройств мочеиспускания. М..: ТЕРРА, 2001. С. 96.
13. Вишневский Е.Л., Лоран О.Б., Пушкарь Д.Ю., Петров С.Б. Обструктивная ноктурия. М.: АНМИ, 2007. 162 с.
14. Карпенко В.С., Колесников Г.Ф., Петрунь Н.М. Функциональная диагностика в урологии и нефрологии. Киев: Здоров’я, 1977. С. 128-131.
15. Джавад-Заде М.Д., Державин В.М., Вишневский Е.Л. Нейрогенные дисфункции мочевого пузыря. М.: Медицина, 1989. 384 c.
16. Кан Д.В. Руководство по акушерской и гинекологической урологии. М.: Медицина, 1978. 456 с.
17. Балан В.Е. Школа по уходу за больными. // Аптечный вестник Вита. 2007. №9. С. 9.
18. Joahim W, Thuroff OAB. Evidence from the Urologist’s Perspective. // Eur. Urol. 2003. № 2. Р. 10-15.
19. Калинченко С.Ю., Апетов С.С. Индивидуализация выбора заместительной гормональной терапии с учетом разных типов климактерических расстройств (с преимущественным дефицитом эстрогенов и андрогенов, по смешанному типу). // Consilium Medicum. 2012. Т. 14. № 6. С. 80-84.
20. Тюзиков И.А., Фомин А.М., Калинченко С.Ю. Диагностическое значение ноктурии как маркера системного гормонально-метаболического дисбаланса. // Материалы XII Съезда Российского общества урологов. Москва, 2012. С. 56-57.
21. Хано М., Малкович С.Б., Вейн А.Дж. Руководство по клинической урологии. [Пер. с англ.] М.: ГЭОТАР-Медиа, 2006. 543 с.
22. Kirby RS, O’Leary MP, Carson C. Efficacy of extended-release doxazosin and doxazosin standard in patients with concomitant benign prostatic hyperplasia and sexual dysfunction. // BJU Int. 2005. № 95. Р. 103–109.
23. Pace G, Palumbo P, Miconi G, Silvestri V, Cifone MG, Vicentini C. PDE-5 and NOS II mRNA expression in menopausal women: a molecular biology study. // World J Urol 2010. Vol.29, № 2. Р. 243-248.
24. Wylie K, Malik F. Review of drug treatment for female sexual dysfunction. // J Urol. 2009. № 10. Р. 671-674.
25. Chute CG, Panser LA, Girman LJ. The prevalence of prostatism: a populationbased survey of urinary symptoms. // J Urol. 1993. Vol. 150. Р. 85-89.
26. Malmsten UGH, Milsom I, Molander U. Urinary incontinence and LUTS: an epidemiological study of men aged 45-99 years. // J Urol. 1997. Vol. 158. Р. 1733-1737.
27. Weiss JP. Nocturia: «do the math». // J Urol. 2006. Vol. 175. № 3. Рt.2. Р. 16-18.
28. McNickolas T. LUTS, the case altered. // Eur Urol. 2002. Vol. 1. № 9. Р. 28-35.
29. Stewart W, Herzog R, Wein AJ. Prevalence and impact of overactive bladder in the US: Results from the NOBLE program. // Neurol Urodyn. 2001. № 20. Р. 403-422.
30. Steers W. Overactive bladder (OAB): What we thought we knew and what we know today. // J Urol. 2002. Vol. 1. Р. 3-10.
31. Herbison P, Hay-Smith J, Ellis G, Moore K. Effectiveness of anticholinergic drugs compared with placebo in the treatment of overactive bladder: systematic review. // BMJ. 2003. № 3. Р.26.
32. Wyndaele J. The overactive bladder. // Br J Urol Int. 2001. Vol. 88. Р. 135-140.
33. Lugaresi E, Cirignotta F, Coccagna G, Piana C. Some epidemiological data on snoring and cardiocirculatory disturbances. // Sleep. 1980. Vol. 3. № 3-4. Р. 221-224.
34. Asplund R. Nocturia in relation to sleep, health and medical treatment in the elderly. // Br. J. Urol. 2002. Vol. 90. Р. 302-313.
35. Bing MH, Jennum P, Mortensen S. Nocturia in relation to sleep quality in an unselected population of women and men 60-80 years in Denmark. // ICS and IUGA Abstracts. Paris, 2004. Р. 179.
36. Umlauf MG, Chasens TR, Greevy RA. Obstructive sleep apnea, nocturia and polyuria in older adults. // Sleep. 2004. Vol. 27. № 1. Р. 139-144.
37. Тюзиков И.А., Фомин А.М., Калинченко С.Ю. Ноктурия как новый интегративный маркер системных нарушений метаболизма у мужчин. // Материалы 1-го Конгресса урологов Сибири. Кемерово, 2012. С. 335-338.
38. Дильман В.М. Эндокринологическая онкология. М.: Медицина, 1983.
39. Балан В.Е., Анкирская А.С., Есесидзе З.Т., Муравьева В.В. Патогенез атрофического цистоуретрита и различные виды недержания мочи у женщин в климактерии. // Consilium Medicum. 2001. Т.3. № 7. С. 326-331.
40. Тумилович Л.Г., Геворкян М.А. Справочник гинеколога-эндокринолога. М.: Практическая медицина. 2010. 208 с.
41. Karazindiyanoğlu S, Cayan S. The effect of testosterone therapy on lower urinary tract symptoms/bladder and sexual functions in men with symptomatic lateonset hypogonadism. // Aging Male. 2008. Vol. 11. № 3. Р. 146-149.
42. Koritsiadis G, Stravodimos K, Mitropoulos D. Androgens and bladder outlet obstruction: a correlation with pressure-flow variables in a preliminary study. // BJU Int. 2008. Vol. 101. Р. 1542–1546.
43. Урология. Национальное руководство. [Под ред. Лопаткина Н.А.] М.: ГЭОТАР-Медиа, 2009. 1024 с.
44. Храйчик Д., Седор Д.Е., Ганц М.Б. Секреты нефрологии. [Пер. с англ.] М.СПб: Бином Невский диалект. 2001. 303 с.
45. Батюшин М.М. Нефрология. Ключи к трудному диагнозу. Элиста. ЗАОр НПП «Джангар». 2009. 168 с.
46. Abracham L, Haeendran A, Millis IW. Development and validation of qualityoflife measure for men with nocturia. // Urol. 2004. Vol. 63. Р. 481-486.
47. Аполихин О.И., Ромих В.В., Иванова Г.Е. Рекомендации по ведению больных с нейрогенными нарушениями мочеиспускания. // Экспериментальная и клиническая урология. 2010. Прил.1. № 3. С.1-48.
48. Stehouwer CD, Henry RM, Ferreira I. Arterial stiffness in diabetes and the metabolic syndrome: a pathway to cardiovascular disease. // Diabetologia. 2008. Vol. 51. Р. 527–539.
49. Creager MA, Löscher TF, Cosentino F, Beckman JA. Diabetes and vascular disease: pathophysiology, clinical consequences, and medical therapy: part I. // Circulation. 2003. Vol. 108. Р. 1527–1532.
50. Verma S, Wang CH, Li SH. A self-fulfilling prophecy: C-reactive protein attenuates nitric oxide production and inhibits angiogenesis. // Circulation. 2002. Vol. 106. Р. 913–919.
51. Corona G, Manucci E, Forti G, Maggi M. Hypogonadism, ED, metabolic syndrome and obesity: a pathological link supporting cardiovascular diseases. // Int J. Androl. 2009. Vol. 32. Р. 587–598.
52. Tsai YC, Liu CH. Urinary incontinence among Taiwanese women: an outpatient study of prevalence, comorbidity, risk factors, and quality of life. // Int UrolNephrol. 2009. Vol. 41. Р. 795–803.
53. Lawrence JM, Lukacz ES, Liu IL. Pelvic floor disorders, diabetes, and obesity in women: findings from the Kaiser Permanente Continence Associated Risk Epidemiology Study. // Diabetes Care. 2007. Vol. 30. Р. 2536–2541.
54. Danforth KN, Townsend MK, Curhan GC. Type 2 diabetes mellitus and risk of stress, urge and mixed urinary incontinence. // J Urol. 2009. Vol. 181. Р. 193–197.
55. Phelan S, Kanaya AM, Subak LL. Prevalence and risk factors for urinary incontinence in overweight and obese diabetic women: action for health in diabetes (look ahead) study. // Diabetes Care. 2009. Vol. 32. Р. 1391–1397.
56. Gorbachinsky I, Akpinar H, Assimos DG. Metabolic Syndrome and Urological Deseases. // ReVol Urol. 2010. Vol. 12. № 4. Р. 157-180.
57. Azadzoi KM, Babayan RK, Kozlowski R. Chronic ischemia increases prostatic smooth muscle contraction in the rabbits. // J Urol. 2003. Vol. 170. № 2. Pt. 1. Р. 659–663.
58. Kozlowski R, Kershen RT, Siroky MB. Chronic ischemia alters prostate structure and reactivity in rabbits. // J Urol. 2001. Vol. 165. Р. 1019–1026.
59. Miller KK, Biller BM, Beauregard C, Lipman JG, Jones J, Schoenfeld D, Sherman JC, Swearingen B, Loeffler J, Klibanski A. Effects of testosterone replacement in androgendeficient women with hypopituitarism: a randomized, double-blind, placebocontrolled study. // J Clin Endocrinol Metab. 2006. Vol. 91. № 5. Р. 1683-1690.
60. Shifren JL, Glenn D. Transdermal Testosterone Treatment in Women with Impaired Sexual Function after Oophorectomy. // N Engl J Med. 2000. Vol. 343. № 10. Р. 682-688.







