ВВЕДЕНИЕ
В последний день 2019 года Всемирная организация здравоохранения (ВОЗ) получила сообщение об обнаружении в Китае случаев пневмонии, вызванной неизвестным вирусом [1]. И уже 11 марта 2020 года ВОЗ объявила пандемию нового заболевания, названного COVID-19 [2]. COVID-19 вызывается вирусом SARSCoV-2 (Severe acute respiratory syndrome-related coronavirus 2), из семейства Коронавирусов, который является оболочечным одноцепочным (+)РНК-вирусом. В состав оболочки вируса входят несколько белков: S (spike), E (envelope), M (membrane), из которых именно S-белок позволяет вирусу прикрепиться и слиться с мембраной клетки-хозяина, в частности субъединица S1 катализирует прикрепление, а S2 – слияние [3]. Эксперименты с моделированием третичной структуры S-белка показали, что он обладает высокой аффинностью к рецептору ангиотензин-превращающего фермента типа 2 (ACE2) и вирус использует его для проникновения внутрь клетки [4]. Кроме того, критически важным для проникновения вируса в клетку и распространения считается рецептор трансмембранной сериновой протеазы 2 (TMPRSS2).
Несмотря на то, что основными клиническими симптомами COVID-19, определяющими его тяжесть, являются респираторные симптомы (кашель, одышка, снижение оксигенации) и признаки общей интоксикации (лихорадка, общая слабость) нельзя исключать его влияния и на мужскую репродуктивную функцию. Это в первую очередь связано с тем, что во время вспышки тяжелого острого респираторного синдрома (SARS) в 2002 году, который вызывается гомологичным вирусу SARS-CoV-2 на 76% вирусом SARS-CoV, после аутопсии мужчин, умерших от SARS, было продемонстрировано поражение яичек, сопровождающееся лейкоцитарной (CD68+) и лимфоцитарной (CD3+) инфильтрацией семенных канальцев и отложением иммуноглобулинов класса G (IgG), несмотря на отсутствие прямого обнаружения вирусных частиц в ткани яичек [5]. Лимфоциты и макрофаги могут влиять на функции клеток Лейдига и, в свою очередь, выработку тестостерона, проникая через гематотестикулярный барьер и повреждая сперматогенный эпителий напрямую. Та же самая гистологическая картина обнаруживалась и в аутопсийном материале из яичек пациентов, умерших от COVID19 [6, 7]. О возможности поражения ткани яичек при COVID-19 наводят результаты работы H. Xu и соавт., которые показали, что рецептор АСЕ2 экспрессируется в ткани придатка яичка приблизительно в 1,7 раза больше, чем в легких [8, 9]. При этом плотность рецепторов АСЕ2 в яичках зависит от возраста. В возрасте 17- 25 лет плотность рецепторов выше на 57,5% чем у 60-летних мужчин в возрасте 60 лет [10]. Любопытно, что совместная экспрессия генов ACE2 и TMPRSS2 из всех изученных типов тканей была обнаружена только в сперматогониях и удлиненных сперматидах [10, 11].
В настоящее время существуют отдельные сообщения о поражении яичек у пациентов, перенесших COVID-19, вплоть до возникновения геморрагического инфаркта яичка [7, 12-16].
Существующие на сегодня данные, касающиеся обнаружения вируса SARS-CoV-2 в эякуляте, противоречивы, однако большинство авторов не подтверждают его наличия как при анализе образцов, полученных от мужчин в острую фазу заболевания, так и от выздоровевших мужчин (табл. 1). SARS-CoV-2 был обнаружен только в одном исследовании [17].
Таблица 1. Частота обнаружения вируса SARS-CoV-2 в эякуляте по данным различных авторов
Table 1. The frequency of detection of the SARS-CoV-2 virus in the ejaculate according to various authors
| Исследование Study |
n | Результат Result |
Комментарий и дополнительные находки Comment and additional findings |
|---|---|---|---|
| H. Li и соавт. [6] H. Li et al. [6] |
23 | — | Были обнаружены изменения в 7 яичках Changes were found in 7 testicles |
| D.Li и соавт. [17] D.Li et al. [17] |
38 | 6 (15,8%) | |
| D. Paoli и соавт. [18] D. Paoli et al. [18] |
1 | — | |
| C. Song и соавт. [19] C. Song et al. [19] |
12 | — | |
| F.Pan и соавт. [20] F.Pan et al. [20] |
34 | — | 6 (19%) страдали от дискомфорта в яичках 6 (19%) suffered from testicular discomfort |
| N. Holtmann и соавт. [21] N. Holtmann et al. [21] |
18 | — | объем спермы, ↓ концентрация сперматозоидов, ↓ количество сперматозоидов, ↓ процент (%) прогрессивно подвижных сперматозоидов, ↓% от общей подвижности ↓ sperm volume, ↓ sperm concentration, ↓ sperm count, ↓ percentage (%) of progressively motile sperm, ↓% of total motility |
| L. Ma и соавт. [22] L. Ma et al. [22] |
12 | — | 33% образцов показали ↓ подвижность сперматозоидов, ↑ индекс фрагментации ДНК ↓ нормальную морфологию сперматозоидов, ↓ общее количество сперматозоидов 33% of samples showed ↓ sperm motility, ↑ DNA fragmentation index, ↓ normal sperm morphology, ↓ total sperm count |
| B. Kayaaslan и соавт. [23] B. Kayaaslan et al. [23] |
16 | — | |
| J. Ning и соавт. [24] J. Ning et al. [24] |
17 | — | |
| I.Guo и соавт. [ 25] I. Guo et al. [6] |
23 | — | |
| ИТОГО TOTAL |
194 | 6 (3,1%) |
Другим важным аспектом патогенеза COVID-19 являет влияние уровня тестостерона на вероятность инфицирования. Еще во время вспышки SARS в 2002 году было отмечено, что уровень смертности среди мужчин был значительно выше (р<0,00001) по сравнению с женщинами: 21,9% против 13,2%, относительный риск составил 1,66 и 1,62 после коррекции по возрасту [26]. Мета-анализ гендерного распределение смертности, наблюдавшейся во время вспышки MERS в 2012 году показал, что инфицированные мужчины, как правило, умирали чаще, чем женщины, и совокупное отношение шансов смерти среди мужчин по сравнению с женщинами составило 1,4 (95% ДИ: 1,1-1,6). Значение I2 полового различия риска смерти составило 48,6% [27].
Изучение статистики заболеваемости и смертности от COVID-19 также показывает, что по сравнению с женщинами, у мужчин с COVID-19 отмечается более высокий уровень госпитальной смертности (13,8% против 10,2% соответственно, p<0,001); более высокая частота необходимости интубации трахеи (21,4% против 14,6%, p<0,001); и более длительная госпитализация (9,5±12,5 дней против 7,8±9,8 дней, p<0,001). Смертность в больницах, проанализированная в соответствии с возрастными группами, расой/этнической принадлежностью и наличием ранее существовавших сопутствующих заболеваний, неизменно показывала более высокий уровень смертности среди мужчин по сравнению с женщинами. Взрослые мужчины с COVID-19 были связаны с более высокими шансами смертности по сравнению с женщинами во всех возрастных группах, причем эффект был наиболее выражен в возрастной группе 18–30 лет (ОШ 3,02; 95% ДИ 2,41–3,78) [28]. Дезагрегированные по полу данные смертности, представляемые официальными органами власти различных государств, показывают, что в 90 из 96 стран мужская смертность от COVID-19 выше, чем женская с коэффициентом от 1,1:1 до 6,73:1 [29]. Анализ большой когорты пациентов с лабораторно подтвержденным SARS-CoV-2, направленных в начале пандемии в отделения интенсивной терапии региона Ломбардия показал, что из 1591 пациента, 1304 (82%) были мужчинами [30].
Центр по контролю и профилактике заболеваний США (CDC) сообщил, что 54% смертей от COVID-19 были среди мужчин [31]. В мета-анализе 3 111 714 зарегистрированных случаев в мире у пациентов-мужчин были более высокие шансы смерти по сравнению с пациентами-женщинами (ОШ = 1,4; 95% ДИ: 1,31-1,47) [32]. Также имеются достоверные сведения, о том что среди мужчин чаще отмечается более тяжелое течение заболевания [33]. Это может быть связано с тем, что помимо рецептора ACE2 для закрепления вируса SARS-CoV-2 на поверхности клеток нужен протеолитический прайминг вирусного S-белка [34]. Этот прайминг осуществляется ферментом, известным как трансмембранная протеаза серин-2 (TMPRSS2). Транскрипция TMPRSS2, как раз и обеспечивается наличием активированного андрогенного рецептора [35]. Может существовать и обратная взаимосвязь, так Ф.Р. Асфандияров и соавт. сообщают о возможном развитии у мужчин постковидного транзиторного гипогонадизма и эректильной дисфункции [36].
В связи с изложенным целью нашего исследования было изучение влияние уровня половых гормонов на течение COVID-19 у мужчин и женщин, а также влияние COVID-19 на сперматогенез.
МАТЕРИАЛЫ И МЕТОДЫ
C целью улучшения оказания специализированной медицинской помощи пациентам с новой коронавирусной инфекцией (COVID-19) и определения влияния COVID-19 на репродуктивное здоровье в исследование были включены 24 человека (12 мужчин и 12 женщин) перенесших новую коронавирусную инфекцию (COVID-19) в период с марта 2020 по сентябрь 2021 года.
Данное исследование было проведено для решения следующих задач:
- изучить вероятность проникновения РНК вируса SARS-CoV-2 в эякулят пациентов, страдающих COVID-19;
- изучить особенности гормонального профиля мужчин и женщин и его влияния на течение заболевания;
- изучить непосредственные и отдаленные последствия инфекции SARS-CoV-2 для мужской и женской репродуктивной системы.
В исследование были включены 12 мужчин и 12 женщин репродуктивного возраста (18-55 лет для мужчин и 18-45 лет для женщин), с положительным анализом мазка из ротоглотки на РНК вируса SARS-CoV-2, находящиеся на лечении в инфекционном отделении, или отделении реанимации и интенсивной терапии в клинической больнице «РЖД-Медицина», г. Нижний Новгород.
В качестве переменных, связанных с госпитализацией, оценивались тяжесть поражения по компьютерной томографии (КТ) и уровень SpO2 при поступлении, длительность госпитализации, попадание в ОРИТ, длительность нахождения в ОРИТ, необходимость кислородной терапии, необходимость интубации трахеи. Более подробная характеристика исследуемой популяции указана в таблице 2.
Таблица 2. Характеристика исследуемой популяции (А – группа пациентов мужского пола; В – группа пациентов женского пола)
Table 2. Characteristics of the study population (A – group of male patients; B – group of female patients)
| A | Минимум Mimimum |
Максимум Maximum |
Среднее Mean |
Среднеквадратичное отклонение Standard deviation |
|---|---|---|---|---|
| Возраст, лет Age, years | 22 | 50 | 33,42 | 9,16 |
| Уровень гормонов в сыворотке крови / Serum hormone levels | ||||
| Общий тестостерон, нг/мл Total testosterone, ng/ml | 1,63 | 6,02 | 3,59 | 1,41 |
| ГСПГ, нмоль/л SHBG, nmol/l | 12,80 | 52,00 | 30,63 | 13,27 |
| ЛГ, мМЕ/мл LH, mIU/ml | 3,05 | 8,25 | 6,27 | 1,65 |
| Эстрадиол, пмоль/л Estradiol, pmol/l | 18,35 | 123,60 | 59,05 | 35,87 |
| Ингибин В, пг/мл Inhibin B, pg/ml | 51,75 | 302,12 | 161,87 | 58,98 |
| Исследование эякулята / Ejaculate analysis | ||||
| Объем, мл Volume, ml |
0,50 | 5,00 | 2,93 | 1,30 |
| рН | 7,00 | 8,50 | 7,79 | 0,49 |
| Концентрация сперматозоидов, млн/мл Sperm concentration, mln/ml |
9 | 110 | 48,25 | 36,18 |
| Активно-подвижные сперматозоиды, % Active motility spermatozoa, % |
10 | 65 | 42,50 | 17,75 |
| Мало-подвижные сперматозоиды, % Non-active motility spermatozoa, % |
5 | 70 | 21,25 | 18,07 |
| Неподвижные сперматозоиды, % Nonmotile spermatozoa, % |
11 | 70 | 36,25 | 15,80 |
| Морфологически нормальные формы сперматозоидов, % Normal morphology spermatozoa, % |
2 | 6 | 3,58 | 1,31 |
| B | Минимум Mimimum |
Максимум Maximum |
Среднее Mean |
Среднеквадратичное отклонение Standard deviation |
|---|---|---|---|---|
| Возраст, лет Age, years | 22,00 | 43,00 | 32,67 | 8,07 |
| Тяжесть поражения легких по КТ, % Severity according to CT, % | 12,00 | 50,00 | 28,83 | 10,62 |
| С-реактивный белок, мг/л C-reactive protein, mg/l | 3,50 | 15,40 | 8,35 | 3,92 |
| СОЭ, мм/ч ESR, mm/h | 21,00 | 50,00 | 36,58 | 9,40 |
| Лейкоциты сыворотки крови 109 /л Leukocytes, 109 /l | 6,28 | 15,73 | 10,18 | 3,02 |
| Длительность госпитализации, дней Hospital stay, days | 8,00 | 16,00 | 12,25 | 2,18 |
| SMART-COP, баллы SMART-COP, scores | 1,00 | 2,00 | 1,17 | 0,39 |
| CRB-65, баллы CRB-65, scores | 0,00 | 1,00 | 0,25 | 0,45 |
| Уровень гормонов в сыворотке крови / Serum hormone levels | ||||
| Общий тестостерон, нг/мл Total testosterone, ng/ml | 0,54 | 1,66 | 1,08 | 0,33 |
| ГСПГ, нмоль/л SHBG, nmol/l | 18,00 | 69,00 | 45,33 | 17,64 |
| ЛГ, мМЕ/мл LH, mIU/ml | 0,69 | 15,05 | 8,10 | 4,33 |
| ФСГ, мМЕ/мл FSH, mIU/ml | 2,61 | 9,89 | 5,85 | 2,48 |
| Эстрадиол, пмоль/л Estradiol, pmol/l | 157,00 | 844,00 | 533,08 | 225,71 |
| Прогестерон, нмоль/л Progesterone, nmol/l | 1,80 | 8,60 | 4,12 | 2,10 |
SMART-COP - шкала оценки необходимости вазопрессорной и респираторной поддержки при внебольничной пневмонии; CRB-65 – шкала оценки тяжести пневмонии
SMART-COP – a scale for assessing the need for vasopressor and respiratory support in community-acquired pneumonia; CRB-65 – pneumonia severity rating scale
Пациентам мужского пола выполнялся анализ эякулята в соответствии с 5-м изданием руководства ВОЗ, исследование эякулята методом полимеразной цепной реакции (ПЦР-тест) на наличие РНК вируса SARS-CoV-2, а также анализ крови на гормоны (общий тестостерон, глобулин, связывающий половые гормоны (ГСПГ), лютеинизирующий гормон (ЛГ), эстрадиол, ингибин В). Через 3-4 месяца после выписки пациентам выполнялся повторный анализ эякулята. Женщинам в рамках исследования выполнялся анализ крови на гормоны (ГСПГ, ЛГ, фолликулостимулирующий гормон (ФСГ), эстрадиол, прогестерон), а также ультразвуковое исследование органов малого таза.
Для оценки тяжести состояния и течения заболевания использовалась шкала SMART-COP. Данная шкала разработана Австралийской рабочей группой по внебольничной пневмонии и основана на оценке тяжести путем выявления пациентов, нуждающихся в интенсивной респираторной поддержке и инфузии вазопрессоров с целью поддержания адекватного уровня АД. Шкала SMART-COP предусматривает балльную оценку клинических, лабораторных, физических и рентгенологических признаков с определением вероятностной потребности в указанных выше интенсивных методах лечения. Также применялась шкала CRB-65 – это более простой подход оценки риска неблагоприятного исхода при ВП, который предлагает анализировать лишь 4 признака: 1) уровень сознания; 2) частоту дыхательных движений; 3) артериальное давление; 4) возраст больного. CRB-65 наиболее популярна при оценке риска летального исхода и выбора места лечения пациентов с внебольничной пневмонией в странах Европы.
Статистическая обработка данных проводилась с использованием пакета программ SPSS Statistics. Анализ данных выполнили с использованием описательной статистики. При этом оценивались средние значения и медианы, стандартные отклонения величин. Оценку наличия статистически значимых отличий между сравниваемыми группами проводили с использованием непараметрического U-критерия Манна-Уитни.
Для выявления взаимосвязи и взаимовлияния различных факторов был использован метод ранговой корреляции по Спирмену. С целью определения характера взаимного стохастического влияния изменения двух случайных метрических величин применялся коэффициент корреляции Пирсона. При описании результатов в группах используется среднее с указанием стандартного отклонения. В связи с тем, что группы равнозначны по числу участников, для описания достоверности используется непарный t-тест.
РЕЗУЛЬТАТЫ
При анализе возможного влияния гормонального фона на тяжесть течения COVID-19 наличие взаимосвязи между параметрами госпитализации и уровнем гормонов при поступлении мы оценили, как у мужчин, так и у женщин. Среди группы пациентов мужского пола была выявлена статистически достоверная связь между уровнем общего тестостерона и уровнем С-реактивного белка (r=0,66; p=0,02), а также между уровнем эстрадиола и необходимостью оксигенотерапии (r=0,751; p=0,005). Более подробные данные по корреляции исследуемых параметров можно найти в таблице 3.
Таблица 3. Корреляция уровня гормонов с параметрами госпитализации у пациентов мужского пола
Table 3. Correlation of hormone levels with hospitalization parameters among male patients
| Тяжесть КТ Severity on CT |
С-РБ CRP |
СОЭ ESR |
Лейкоциты WBC |
Длительность госпитализации Hospital stay |
Оксигенация Оxygen therapy |
SMART-COP | CRB-65 | ||
|---|---|---|---|---|---|---|---|---|---|
| Возраст, лет Age, years |
r | 0,021 | 0,425 | 0,248 | 0,135 | 0,152 | -0,336 | -0,021 | -0,021 |
| p | 0,948 | 0,169 | 0,437 | 0,676 | 0,637 | 0,286 | 0,948 | 0,948 | |
| Общий тестостерон, нг/мл Total testosterone, ng/ml |
r | 0,185 | 0,660* | -0,284 | 0,113 | 0,149 | 0,065 | -0,030 | -0,030 |
| p | 0,564 | 0,020 | 0,372 | 0,726 | 0,643 | 0,841 | 0,927 | 0,927 | |
| ГСПГ, нмоль/л SHBG, nmol/l |
r | 0,463 | 0,490 | 0,249 | 0,385 | -0,093 | 0,064 | -0,219 | -0,219 |
| p | 0,130 | 0,106 | 0,435 | 0,217 | 0,773 | 0,845 | 0,493 | 0,493 | |
| ЛГ, мМЕ/мл LH, mIU/ml |
r | 0,182 | 0,149 | 0,213 | 0,153 | 0,057 | -0,071 | 0,261 | 0,261 |
| p | 0,571 | 0,644 | 0,505 | 0,634 | 0,859 | 0,826 | 0,413 | 0,413 | |
| Эстрадиол, пмоль/л Estradiol, pmol/l |
r | -0,035 | 0,383 | -0,088 | 0,423 | 0,387 | 0,751** | 0,250 | 0,250 |
| p | 0,913 | 0,219 | 0,785 | 0,171 | 0,214 | 0,005 | 0,433 | 0,433 | |
| Ингибин В, пг/мл Inhibin B, pg/ml |
r | -0,439 | -0,510 | -0,359 | -0,449 | -0,138 | 0,309 | -0,133 | -0,133 |
| p | 0,153 | 0,091 | 0,252 | 0,143 | 0,669 | 0,328 | 0,681 | 0,681 | |
* – корреляция значима на уровне 0,05 (двухсторонняя)
** – корреляция значима на уровне 0,01 (двухсторонняя)
* – correlation is significant at the level of 0.05 (two-tailed)
** – correlation is significant at the level of 0.01 (two-tailed)
Единственным статистически значимым результатом корреляционного анализа в женской популяции оказалась отрицательная взаимосвязь между уровнем общего тестостерона и необходимостью оксигенотерапии (r= -0,62; p=0,03) (табл. 4).
Таблица 4. Корреляция уровня гормонов с параметрами госпитализации у пациентов женского пола
Table 4. Correlation of hormone levels with hospitalization parameters among female patients
| Тяжесть КТ Severity on CT |
С-РБ CRP |
СОЭ ESR |
Лейкоциты WBC |
Длительность госпитализации Hospital stay |
Оксигенация Оxygen therapy |
SMART-COP | CRB-65 | ||
|---|---|---|---|---|---|---|---|---|---|
| Возраст, лет Age, years |
R | 0,04 | -0,05 | 0,18 | 0,22 | -0,37 | -0,07 | -0,21 | -0,40 |
| P | 0,91 | 0,87 | 0,57 | 0,49 | 0,24 | 0,82 | 0,51 | 0,20 | |
| Общий тестостерон, нг/мл Total testosterone, ng/m |
R | -0,18 | -0,05 | 0,45 | 0,47 | -0,24 | -0,62* | -0,35 | -0,03 |
| P | 0,57 | 0,88 | 0,14 | 0,13 | 0,46 | 0,03 | 0,26 | 0,92 | |
| ГСПГ, нмоль/л SHBG, nmol/l |
R | 0,16 | 0,13 | 0,19 | 0,32 | 0,03 | 0,23 | -0,05 | -0,10 |
| P | 0,62 | 0,69 | 0,55 | 0,32 | 0,92 | 0,48 | 0,88 | 0,75 | |
| ЛГ, мМЕ/мл LH, mIU/ml |
R | -0,45 | 0,20 | -0,07 | 0,29 | -0,18 | -0,45 | -0,53 | -0,28 |
| P | 0,14 | 0,53 | 0,84 | 0,37 | 0,59 | 0,14 | 0,08 | 0,39 | |
| ФСГ, мМЕ/мл FSH, mIU/ml |
R | -0,09 | 0,35 | -0,19 | 0,06 | -0,15 | 0,03 | 0,05 | 0,00 |
| P | 0,79 | 0,26 | 0,56 | 0,85 | 0,64 | 0,92 | 0,87 | 10,00 | |
| Эстрадиол, пмоль/л Estradiol, pmol/l |
R | 0,34 | 0,24 | 0,21 | 0,02 | 0,22 | 0,12 | 0,12 | 0,21 |
| P | 0,27 | 0,45 | 0,51 | 0,96 | 0,50 | 0,71 | 0,72 | 0,51 | |
| Прогестерон, нмоль/л Progesterone, nmol/l |
R | 0,46 | -0,29 | 0,03 | -0,37 | 0,14 | 0,39 | 0,40 | 0,27 |
| P | 0,14 | 0,36 | 0,93 | 0,24 | 0,66 | 0,22 | 0,20 | 0,39 | |
* – Корреляция значима на уровне 0,05 (двухсторонняя)
* – correlation is significant at the level of 0.05 (two-tailed)
При выполнении бинарного логистического регрессионного анализа с поправками на возраст и тяжесть поражения при КТ значимость уровня тестостерона, как предиктора необходимости в оксигенотерапии исчезала (табл. 5).
Таблица 5. Результаты множественного логистического анализа
Table 5. Results of the multiple logistic analysis
| Параметр Parameter |
β | Значимость, p Significance, p |
Экспонента (B) Exponent |
|---|---|---|---|
| Возраст, лет Age, years |
-0,633 | 0,999 | 0,531 |
| Тяжесть поражения по КТ Severity on CT |
5,819 | 0,997 | 336,590 |
| Уровень тестостерона Total testosterone |
-100,553 | 0,997 | 0,000 |
При изучении эякулята методом ПЦР-анализа ни в одном случае не было обнаружено присутствие вируса SARS-CoV-2 в образцах обследуемых мужчин. При ультразвуковом исследовании органов мошонки у 1 пациента было выявлено субклиническое варикоцеле и у 1 – киста придатка левого яичка.
При ультразвуковом исследовании органов малого таза у женщин не было выявлено клинически значимых изменений за исключением 1 случая параовариальной кисты яичника.
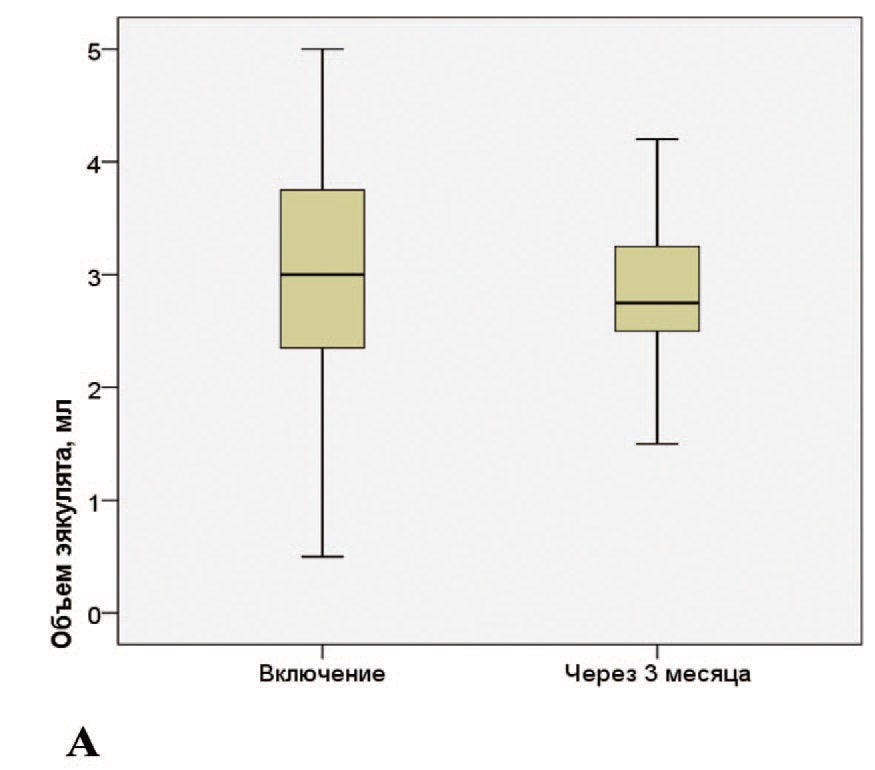
Анализ динамики показателей спермограммы показал отсутствие достоверных изменений основных параметров качества эякулята в течение 3 месяцев с момента госпитализации по поводу COVID-19 (табл. 6). Динамика отдельных параметров эякулята отображена на соответствующих диаграммах на рисунках 1, 2.
Таблица 6. Динамика параметров эякулята
Table 6. Dynamics of semen parameters
| Параметр Parameter | Тяжесть КТ Severity on CT |
С-РБ CRP |
СОЭ ESR |
|
|---|---|---|---|---|
| Объем, мл Volume, ml |
Включение в исследование | 2,93 | 1,30 | 0,482 |
| Через 3 мес | 2,82 | 0,82 | ||
| рН | Включение в исследование | 7,79 | 0,49 | 0,571 |
| Через 3 мес | 7,67 | 0,49 | ||
| Концентрация сперматозоидов, млн/мл Concentration spermatozoa, mln/ml |
Включение в исследование | 48,25 | 36,18 | 0,615 |
| Через 3 мес | 46,50 | 33,80 | ||
| Активно-подвижных сперматозоидов, % Active motility spermatozoa, % |
Включение в исследование | 42,50 | 17,75 | 0,763 |
| Через 3 мес | 40,08 | 18,56 | ||
| Малоподвижных сперматозоидов, % Non-active motility spermatozoa, % |
Включение в исследование | 21,25 | 18,07 | 0,852 |
| Через 3 мес | 22,33 | 14,11 | ||
| Неподвижных сперматозоидов, % Nonmotile spermatozoa, % |
Включение в исследование | 36,25 | 15,80 | 0,791 |
| Через 3 мес | 37,58 | 16,76 | ||
| Морфологически нормальные формы, % Normal morphology, % |
Включение в исследование | 3,58 | 1,31 | 0,674 |
| Через 3 мес | 3,83 | 1,46 | ||
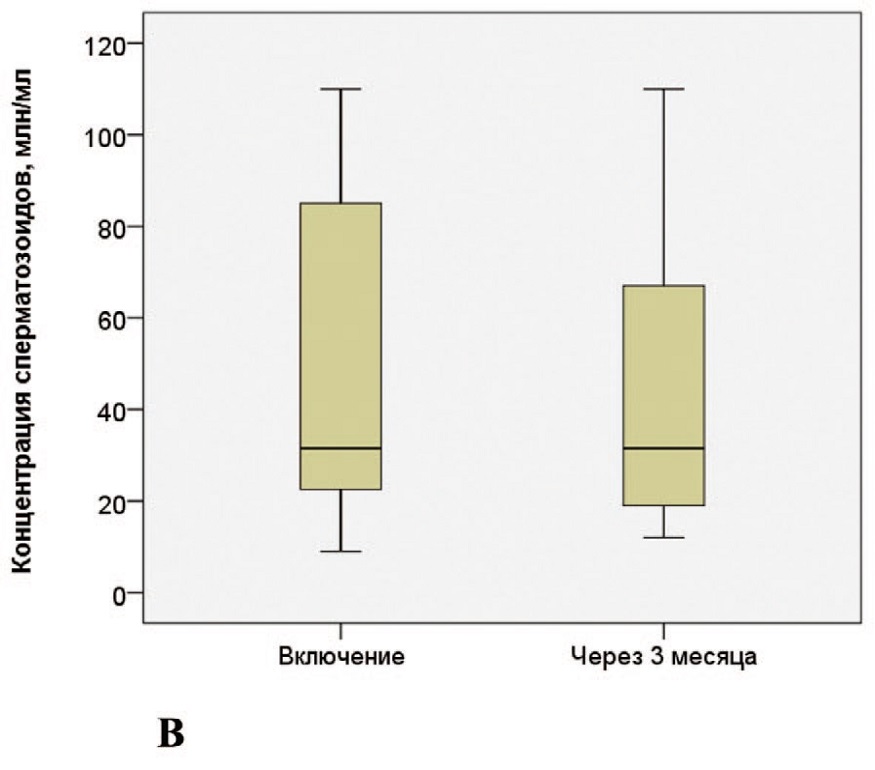
Рис. 1. А – изменение объема эякулята; В – изменение концентрации сперматозоидов
Fig. 1. A – сhanges of ejaculate volume; B – сhanges of spermatozoa concentration
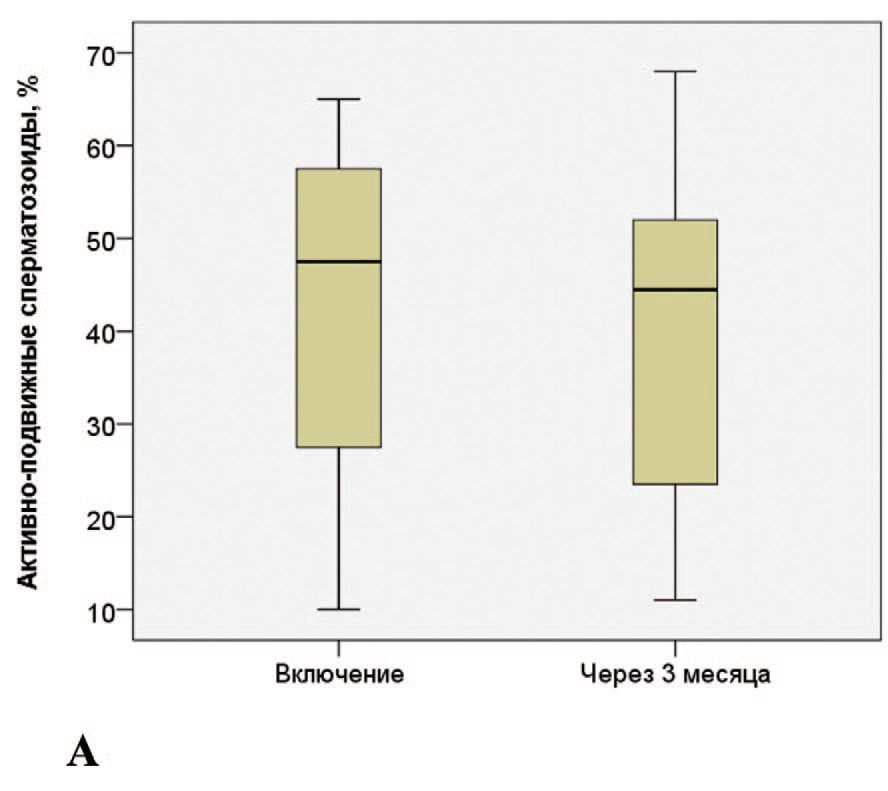
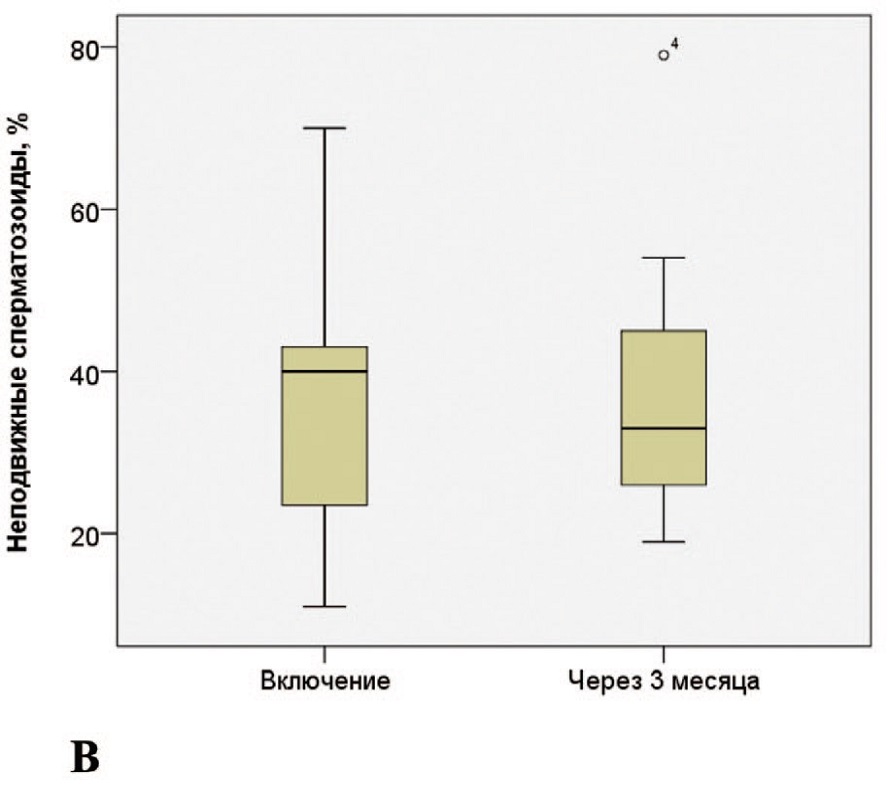
Рис. 2. Изменение показателей подвижности сперматозоидов. А – активно-подвижных сперматозоидов, В – неподвижных сперматозоидов.
Fig. 2. Change in indicators of sperm motility. A – active-motile spermatozoa, B – non-motile spermatozoa.
ОБСУЖДЕНИЕ
Полученные нами результаты в целом согласуются с имеющимися литературными данными. Отсутствие генетического материала вируса в эякуляте пациентов в остром периоде заболевания может говорить у низком риске контаминации спермы SARS-CoV-2 и отсутствии риска передачи вируса половым путем в противоположность другим РНК-вирусам (вирус Зика, вирус гепатита С, ВИЧ) [37, 38]. Однако, учитывая небольшой размер выборки, необходимо проведение более масштабных исследований, в том числе с применением полногеномного секвенирования образцов эякулята для детекции отдельных частей вируса.
Многие работы описывают различные варианты возможного влияния COVID-19 на сперматогенез. В нашем исследовании не было обнаружено негативного влияния коронавирусной инфекции на концентрацию, подвижность и морфологию сперматозоидов непосредственно в острый период заболевания и через 3 месяца после выписки. Вместе с этим существует вероятность поражения репродуктивных органов в более отдаленной перспективе, например, за счет образования антиспермальных антител. Подобный механизм нарушения фертильности у пациентов после COVID-19 описан G. Donders и соавт., которые обнаружили, что у 13,2% мужчин в течение 1 месяца после перенесенного COVID-19 обнаружились антиспермальные антитела (IgA), что может приводить к сниженной фертильности и еще у 0,9% больных уровень антиспермальных IgA превышал 90%, что свидетельствует об иммунологическом бесплодии [39].
Интересной находкой при корреляционном анализе стала отрицательная связь между уровнем тестостерона и необходимостью оксигенотерапии у женщин. Это поддерживает существующую точку зрения, что андрогены (в том числе у женщин) играют важную роль в развития клинических проявлений коронавирусной инфекции и влияют на ее тяжесть. Однако до сих пор нет консенсуса, относительно характера такого влияния. Одни исследования говорят, что высокий уровень тестостерона усугубляет течение COVID-19, другие исследователи сообщают о более высокой частоте госпитализации в ОРИТ пациентов с гипогонадизмом [40, 41]. Третьи же выражают мнение о наличии U-образной связи, при которой негативно сказываются на состоянии пациента как высокие, так и низкие уровни андрогенов [42]. Однако, при регрессионном анализе с поправкой на возраст и тяжесть поражения, нами обнаруженно, что эта взаимосвязь пропадала.
ВЫВОДЫ
Таким образом, нами не было обнаружено достоверных доказательств негативного влияния новой коронавирусной инфекции (COVID-19) на параметры эякулята в краткосрочной перспективе. Обнаруженное нами влияние уровня общего тестостерона у женщин на необходимость оксигенотерапии требует дополнительных проспективных исследований на более обширной популяции.
ЛИТЕРАТУРА
1. World Health Organization. Pneumonia of unknown cause – China [Electronic resource]. 2020 [cited 2020 Jan 12]. URL: https://www.who.int/csr/don/05-january-2020-pneumoniaof-unkown-cause-china/en/.
2. World Health Organization. WHO Director-General's opening remarks at the media briefing on COVID-19 – 11 March 2020. [Electronic resource]. URL: https://www.who.int/ director-general/speeches/detail/who-director-general-s-opening-remarks-at-the-mediabriefing-on-covid-19---11-march-2020.
3. Wu C, Liu Y, Yang Y, Zhang P, Zhong Wu, Wang Y, et al. Analysis of therapeutic targets for SARS-CoV-2 and discovery of potential drugs by computational methods. Acta Pharm Sin B 2020;10(5):766-788. https://doi.org/10.1016/j.apsb.2020.02.008.
4. Xu X, Chen P, Wang J, Feng J, Zhou H, Li X, et al. Evolution of the novel coronavirus from the ongoing Wuhan outbreak and modeling of its spike protein for risk of human transmission. Sci China Life Sci 2020;63(3):457-60. https://doi.org/10.1007/s11427-020-1637-5.
5. Xu J, Qi L, Chi X, Yang J, Wei X, Gong E, et al. Orchitis: а complication of severe acute respiratory syndrome (SARS). Biol Reprod 2006;74(2):410-416. https://doi.org/10.1095/ biolreprod.105.044776.
6. Li H, Xiao X, Zhang J, Zafar MI, Wu Ch, Long Y, et al. Impaired spermatogenesis in COVID-19 patients. EClinicalMedicine 2020;28. https://doi.org/10.1016/j.eclinm.2020.100604.
7. Yang M, Chen S, Huang B, Zhong JM, Su H, Chen YJ, et al. Pathological findings in the testes of COVID-19 patients: clinical implications. Eur Urol Focus 2020;6(5):1124-1129. https://doi.org/10.1016/j.euf.2020.05.009.
8. Forrest ARR, Kawaji H, Rehli M, Baillie JK, de Hoon MJ, Haberle V, et al. A promoterlevel mammalian expression atlas. Nature 2014;507(7493):462-470. https://doi.org/10.1038/ nature13182.
9. Lonsdale J, Thomas J, Salvatore M, Phillips R, Lo E, Shad S, et al. The Genotype-Tissue Expression (GTEx) project. Nat Genet 2013;45(6):580-585. https://doi.org/10.1038/ng.2653.
10. Shen Q, Xiao X, Aierken A, Yue W, Wu X, Liao M, et al. The ACE2 expression in Sertoli cells and germ cells may cause male reproductive disorder after SARS-CoV-2 infection. J Cell Mol Med 2020;24(16):9472-9477. https://doi.org/10.1111/jcmm.15541.
11. Stanley KE, Thomas E, Leaver M, Wells D. Coronavirus disease-19 and fertility: viral host entry protein expression in male and female reproductive tissues. Fertil Steril 2020;114(1):33-43. https://doi.org/10.1016/j.fertnstert.2020.05.001.
12. Kim J, Thomsen T, Sell N, Goldsmith AJ. Abdominal and testicular pain: An atypical presentation of COVID-19. Am J Emerg Med 2020;38(7):1542.e1-1542.e3. https://doi.org/10.1016/ j.ajem.2020.03.052.
13. Bridwell RE, Merrill DR, Griffith SA, Wray J, Oliver JJ. A coronavirus disease 2019 (COVID-19) patient with bilateral orchitis. Am J Emerg Med 2021(42):260.e3-260.e5. https://doi.org/10.1016/j.ajem.2020.08.068.
14. La Marca A, Busani S, Donno V, Guaraldi G, Ligabue G, Girardis M. Testicular pain as an unusual presentation of COVID-19: a brief review of SARS-CoV-2 and the testis. Reprod Biomed Online 2020;41(5):903-906. https://doi.org/10.1016/j.rbmo.2020.07.017.
15. Gagliardi L, Bertacca C, Centenari C, Merusi I, Parolo E, Ragazzo V, et al. Orchiepididymitis in a boy with COVID-19. Pediatr Infect Dis J 2020;39(8):E200-E202. https://doi.org/10.1097/INF.0000000000002769.
16. Деревянко Т.И., Придчин С.В. Геморрагический инфаркт яичка как осложнение COVID-19 (SARS-COV-2). Экспериментальная и клиническая урология 2021;14(2):70-72. https://doi.org/10.29188/2222-8543-2021-14-2-70-72. [Derevyanko TI, Pridchin SV. Hemorrhagic testicular infarction as a complication of COVID-19 (SARS-CoV-2). Eksperimentalnaya i klinicheskaya urologiya = Experimental and Clinical Urology 2021;14(2):70-72. (In Russian)].
17. Li D, Jin M, Bao P, Zhao W, Zhang S. Clinical characteristics and results of semen tests among men with coronavirus disease 2019. JAMA Netw open. Published online 2020. https://doi.org/10.1001/jamanetworkopen.2020.8292.
18. Paoli D, Pallotti F, Colangelo S, Basilico F, Mazzuti L, Turriziani O, et al. Study of SARS-CoV-2 in semen and urine samples of a volunteer with positive naso-pharyngeal swab. J Endocrinol Invest 2020;43(12):1819-1822. https://doi.org/10.1007/S40618-020-01261-1.
19. Song C, Wang Y, Li W, Hu B, Chen G, Xia P, et al. Absence of 2019 novel coronavirus in semen and testes of COVID-19 patients. Biol Reprod 2020;103(1):4-6. https://doi.org/10.1093/BIOLRE/IOAA050.
20. Pan F, Xiao X, Guo J, Song Y, Li H, Patel DP, et al. No evidence of severe acute respiratory syndrome-coronavirus 2 in semen of males recovering from coronavirus disease 2019. Fertil Steril 2020;113(6):1135-1139. https://doi.org/10.1016/J.FERTNSTERT.2020.04.024.
21. Holtmann N, Edimiris P, Andree M, Doehmen С, Baston-Buest D, Adams O, et al. Assessment of SARS-CoV-2 in human semen-a cohort study. Fertil Steril 2020;114(2):233-238. https://doi.org/10.1016/J.FERTNSTERT.2020.05.028.
22. Ma L, Xie W, Li D, Shi L, Ye G, Mao Y, et al. Evaluation of sex-related hormones and semen characteristics in reproductive-aged male COVID-19 patients. J Med Virol 2021;93(1):456-462. https://doi.org/10.1002/JMV.26259.
23. Kayaaslan B, Korukluoglu G, Hasanoglu I, Kalem AK, Eser F, Akinci E, et al. Investigation of SARS-CoV-2 in semen of patients in the acute stage of COVID-19 infection. Urol Int 2020;104(9-10):678-683. https://doi.org/10.1159/000510531.
24. Ning J, Li W, Ruan Y. Effects of 2019 Novel Coronavirus on male reproductive system: a retrospective study. Published online April 16, 2020. https://doi.org/10.20944/ PREPRINTS202004.0280.V1.
25. Guo L, Zhao S, Li W, Wang Y, Li L, Jiang S, et al. Absence of SARS-CoV-2 in semen of a COVID-19 patient cohort. Andrology 2021;9(1):42-47. https://doi.org/10.1111/ANDR.12848.
26. Karlberg J, Chong DSY, Lai WYY. Do men have a higher case fatality rate of severe acute respiratory syndrome than women do? Am J Epidemiol 2004;159(3):229-231. https://doi.org/10.1093/AJE/KWH056.
27. Matsuyama R, Nishiura H, Kutsuna S, Hayakawa K, Ohmagari N. Clinical determinants of the severity of Middle East respiratory syndrome (MERS): a systematic review and metaanalysis. BMC Public Health 2016;16(1). https://doi.org/10.1186/S12889-016-3881-4.
28. Nguyen NT, Chinn J, de Ferrante M, Kirby KA, Hohmann SF, Amin A. Male gender is a predictor of higher mortality in hospitalized adults with COVID-19. PLoS One 2021;16(7). https://doi.org/10.1371/JOURNAL.PONE.0254066.
29. 50/50 GH. The COVID-19 sex-disaggregated data tracker. [Electronic resource]. URL: https://globalhealth5050.org/the-sex-gender-and-covid-19-project/the-data-tracker/?explore=variable.
30. Grasselli G, Zangrillo A, Zanella A, Antonelli M, Cabrini L, Castelli A, et al. Baseline characteristics and outcomes of 1591 patients infected with SARS-CoV-2 Admitted to ICUs of the Lombardy Region, Italy. JAMA 2020;323(16):1574-1581. https://doi.org/10.1001/ JAMA.2020.5394.
31. Centers for disease control and prevention coronavirus disease 2019 (COVID-19). Accessed January 30, 2021. [Electronic resource]. URL: https://covid.cdc.gov/covid-datatracker/#cases_casesper100klast7days.
32. Peckham H, de Gruijter NM, Raine C, Radziszewska A, Ciurtin C, Wedderburn LR, et al. Male sex identified by global COVID-19 meta-analysis as a risk factor for death and ITU admission. Nat Commun 2020;11(1). https://doi.org/10.1038/S41467-020-19741-6.
33. Zheng S, Fan J, Yu F, Feng B, Lou B, Zou Q, et al. Viral load dynamics and disease severity in patients infected with SARS-CoV-2 in Zhejiang province, China, January-March 2020: retrospective cohort study. BMJ 2020;369. https://doi.org/10.1136/BMJ.M1443.
34. Hoffmann M, Kleine-Weber H, Schroeder S, Krüger N, Herrler T, Erichsen S, et al. SARSCoV-2 cell entry depends on ACE2 and TMPRSS2 and is blocked by a clinically proven protease inhibitor. Cell 2020;181(2):271-280.e8. https://doi.org/10.1016/J.CELL.2020.02.052.
35. Lucas JM, Heinlein C, Kim T, Hernandez SA, Malik MS, True LD, et al. The androgenregulated protease TMPRSS2 activates a proteolytic cascade involving components of the tumor microenvironment and promotes prostate cancer metastasis. Cancer Discov 2014;4(11):1310-1325. https://doi.org/10.1158/2159-8290.CD-13-1010.
36. Асфандияров Ф.Р., Круглов В.А., Выборнов С.В., Сеидов К.С., Нерсесян А.Ю., Круглова Е.Ю. Постковидный транзиторный гипогонадизм и эректильная дисфункция. Экспериментальная и клиническая урология 2021;14(3):112-118. [Asfandiyarov FR, Kruglov VA, Vybornov SV, Seidov KS, Nersesyan AY, Kruglova EY. Post-COVID-19 transient hypogonadism and erectile dysfunction. Eksperimentalnaya i klinicheskaya urologiya = Experimental and Clinical Urology 2021;14(3):112-118. (In Russian)]. https://doi.org/10.29188/2222-8543-2021-14-3-112-118.
37. Salam AP, Horby PW. The breadth of viruses in human semen. Emerg Infect Dis 2017;23(11):1922-1924. https://doi.org/10.3201/EID2311.171049.
38. Musso D, Roche C, Robin E, Nhan T, Teissier A, Cao-Lormeau VM. Potential sexual transmission of Zika virus. Emerg Infect Dis 2015;21(2):359-361. https://doi.org/10.3201/ EID2102.141363.
39. Donders GGG, Bosmans E, Reumers J, Donders F, Jonckheere J, Salembier G, et al. Sperm quality and absence of SARS-CoV-2 RNA in semen after COVID-19 infection: a prospective, observational study and validation of the SpermCOVID test. Fertil Steril. Published online December 2021. https://doi.org/10.1016/J.FERTNSTERT.2021.10.022.
40. Subramanian A, Anand A, Adderley NJ, Okoth K, Toulis KA, Gokhale K, et al. Increased COVID-19 infections in women with polycystic ovary syndrome: a population-based study. Eur J Endocrinol 2021;184(5):637-45. https://doi.org/10.1530/EJE-20-1163.
41. Apaydin T, Sahin B, Dashdamirova S, Yazan CD, Elbasan O, Ilgin C, et al. The association of free testosterone levels with coronavirus disease 2019. Andrology. Published online January 13, 2022. https://doi.org/10.1111/ANDR.13152.
42. Younis JS, Skorecki K, Abassi Z. The double edge sword of testosterone’s role in the COVID-19 pandemic. Front Endocrinol (Lausanne) 2021(12). https://doi.org/10.3389/ FENDO.2021.607179.