Вице-Президент по исследованиям и разработкам "IsoRay Medikal ", США
Существует прямая, обусловленная физиологически, связь между абляцией опухолевой ткани и последующим иммунологическим ответом. Классическая концепция вакцинации – широко известна. Согласно этой концепции для того, чтобы вакци- нация оказалась успешной, необходимо введение в организм антигена (обычно это белок) или материала, который имитирует этот антиген. Организм, в свою очередь, вырабатывает свой кратко- или долгосрочный иммунологический ответ.
Концепция противораковых вакцин с терапевтической точки зрения является сходной. Для изготовления противораковых вакцин используется какая-либо разновидность антигенного компонента опухоли. Таким образом, это своего рода провокационная терапия, одобренная в США и в некоторых странах Европейского союза, и являющаяся очень быстро развивающейся областью.
Ключевыми компонентами противораковой вакцины являются три аспекта. Вопервых, должен быть в наличии опухолевый антиген – мишень для предстоящей терапии; во-вторых, специфическая система, включающая антигенпрезентирующие клетки, которая работает наподобие моста, для доставки и представления антигена другим иммунокомпетентным клеткам; и, наконец, лимфоцитарная система – она является эффектором и занимается тем, что непосредственно уничтожает опухолевые клетки. И лишь при наличии и адекватном функционировании всех трех компонентов система противораковой вакцины будет работать.
За последнее десятилетие изучено множество антигенов, которые могли бы быть онкоспецифическими, то есть не экспрессироваться нормальными клетками. К сожалению, на сегодняшний день не найдено ни одной белковой молекулы, которая присутствовала бы исключительно в опухолевой ткани. Этот белок всегда в том или ином количестве будет находиться на поверхности огромного множества нормальных клеток организма. Существует несколько типов молекул, которые представляют интерес (MAGE-1 MAGE-3 Tyrosinase, PSA, PSMA, PAP, Her-2/neu), причем не только для урологов, но и для врачей других специальностей. Очень интересной является способность одного рекомбинантного антигена вызывать достаточный для терапии иммунный ответ, предполагающий повсеместное воздействие на все опухоли данного типа. К сожалению, рак по своей природе является гетерогенным и состоит из различных клеток, экспрессирующих различные наборы антигенов. Это главное препятствие для создания универсальной вакцины, которая действовала бы на все без исключения опухолевые клетки.
Одно из самых интересных исследований, иллюстрирующее вышесказанное, было проведено в Университете им. Вашингтона в Сиэтле. В этом исследовании проводилось вскрытие умерших с метастатическим РПЖ, в кратчайшие сроки после наступления смерти пациента, во время которого осуществлялся забор костного материала из метастазов. Несмотря на то, что более 70% опухолевых клеток экспрессировали ПСА, доля ПСА- позитивных клеток сильно различалась в различных образцах (стандартное отклонение > 25%), взятых от одного и того же пациента. От 0 до 95% метастазов у одного пациента имели нейроэндокринный фенотип (позитивны на хромогранин А). Данное исследование подчеркивает гетерогенность метастатического РПЖ – гистологическую и иммунофенотипическую. Поэтому лечение, направленное на фенотип одного из метастазов, не может иметь эффек та в других метастазах, по причине тканевой гетерогенности.
Новая концепция противораковой вакцины
Мы подошли к новой концепции противораковой вакцины. Идея состоит в том, что разрушенная тем или иным образом (механически или термически) опухолевая ткань высвобождает большое число разнообразного и высокоспецифичного антигенного материала, который является первым из ключевых компонентов. Использование аблятивных техник для получения антигенного материала имеет большие преимущества, поскольку поврежденные ткани потенциально имеют множество разновидностей собственных (аутологичных) опухолевых антигенов, в том числе тех, которые не были до сих пор описаны. При использовании аблятивных методов, это может быть достигнуто на локальном уровне (in situ), избавляя от необходимости синтезировать или производить антиген в лаборатории (ex vivo).
Если рассмотреть криоабляцию, то непосредственно после выполнения процедуры всегда отмечается рост сывороточного уровня ПСА, что связано с разрушением и поступлением в кровоток содержимого значительного количества разрушенных клеток предстательной железы (рисунок 1). Сходным же образом выделяются и другие антигены, экспрессируемые в опухолевой ткани. Существует множество этих антигенов, что может говорить нам о гетерогенности фенотипа опухоли. Таким образом, мы имеем значительное количество антигенного материала после криоабляции, для получения адекватного иммунного ответа.
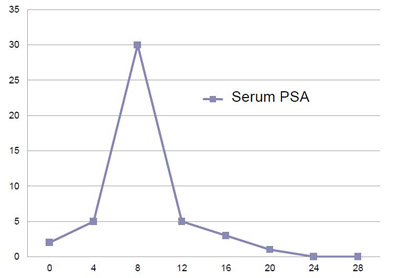
Time (hrs) following cryoablation
Рисунок 1. Пик повышения ПСА после криоабляции
Но это лишь один из необходимых компонентов для создания противораковой вакцины, антигенные компоненты которой могут быть предоставлены аблятивными технологиями.
Как указывалось выше, следующий необходимый компонент для создания вакцины – это иммунная система, вследствие функционирования которой антигенпрезентующие клетки, являющиеся посредниками между опухолевыми антигенами и эффекторными клетками, предоставляют последним антигенный материал.
Если мы взглянем на лимфоцит, основной эффекторный элемент иммунной системы, который действует на высвобожденные при абляции опухоли антигены, то заметим, что на поверхности Т-клеток имеются рецепторы, которые распознаютразличные чужеродные белки, количество которых возрастает, когда он атакует свою цель (рисунок 2). Однако при этом Т-клетка нуждается во множестве ко-стимулирующих сигналов, которые должны присутствовать для увеличения клона клеток, направленных против того или иного антигена, и обеспечивать, таким образом, генерацию иммунного ответа. Ключевым же является тот факт, что недостаточно одного лишь присутствия антигена после абляции опухолевой ткани, необходимы также презентация антигена для рецепторов Т-клеток и присутствие большого количества вспомогательных сигналов в их окружении.
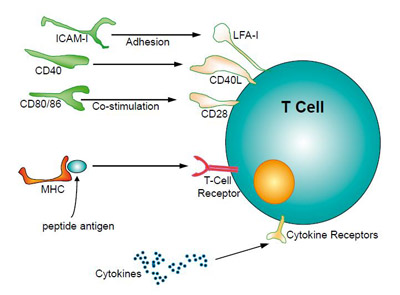
Рисунок 2. Различные сигналы, требующиеся для активации T-клеток
Антигенпрезентирующая клетка (рисунок 3) способна не просто контактировать с поверхностными рецепторами Т-клеток, но и выделять растворимые и рецепторные вещества, стимулирующие Т-клетку. При сочетании всех указанных выше факторов взаимодействия, эффекторная клетка реагирует на антигенный сигнал очень быстро, сила реакции нарастает с логарифмической скоростью, что и обусловливает клинический иммунный ответ.
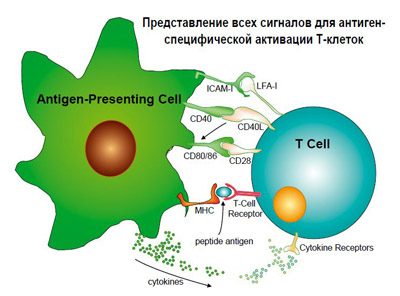
Рисунок 3. Антиген-презентирующие клетки
Дендритные клетки (DC) – это наиболее известная и изученная разновидность антигенпрезентирующих клеток. Одно из исследований доктора Demaria – многокогортное исследование на животных, которым имплантировались опухоли в левую и правую почки (рисунок 4). Опухоль в левой почке никогда не подвергалась лечению. Животные разделялись на 4 группы в зависимости от вида лечения, применяемого к правой почке: без лечения; только иммуностимуляция; только облучение; облучение вместе с иммуностимуляцией. Животные из первых двух групп показали примерно одинаковый уровень роста опухоли с обеих сторон. При использовании облучения рост опухоли в правой почке существенно замедлялся. Когда исследователи использовали одновременное облучение одной опухоли и введение аутологичных дендритных клеток, то помимо уменьшения опухоли на стороне воздействия, было зарегистрировано также заметное подавление опухоли на противоположной стороне. Это очень элегантная демонстрация тормозящего эффекта иммунной системы, и в особенности, вовлеченных DC.
Иммунологически опосредованное ингибирующее влияние ионизирующего излучения на нелеченную опухоль.
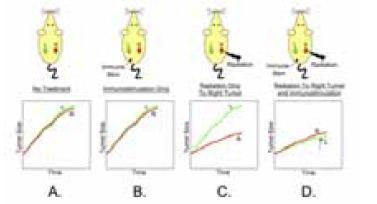
Demaria, et al. IJROBP 58(3):862-70, 2004
Рисунок 4. «Тормозящий» эффект
Доктор Ablin в 1970 г. в Нью-Йорке отметил неожиданную реакцию отдаленных метастазов после криоабляции рака предстательной железы (РПЖ). Им была задокументирована регрессия метастазов РПЖ, с локализацией в позвоночнике, после криоабляции простаты. В то время механизм данной реакции остался не раскрытым.
Одно из исследований на крысах со сходным дизайном было опубликовано несколько лет назад. Опухоль спонтанно метастазировала в легкие. После криоабляции опухоли простаты была отмечена активизация DC, что сопровождалось замедлением роста легочных метастазов. Животные, которые подвергались криоабляции и введению DC показали лучший профиль выживаемости.
Наша идея состоит в объединении аблятивных и клеточных технологий. Мы верим, что DC служат связующим звеном между лимфоцитами и антигенами опухоли. Однако, в итоге, ответственной за результат иммунной терапии должна быть эффекторная система.
Иммунная система имеет две функции (рисунок 5). Одна из них стимулирующая/цитотоксическая – проявляется путем активации иммунного ответа и усиления активности эффекторов (Т-клетки, В-клетки, антитела), способных к непосредственному уничтожению чужеродных антигенов. Другая, зеркальное ее отражение – это регуляторная/защитная функция, в виде регуляторных Т-клеток, задача которой в ослаблении иммунного ответа. И до тех пор, пока мы не поймем, как эта система работает, мы не сможем регулировать взаимодействие двух противоположных сторон иммунной системы.
Цитотоксический/Стимулирующий
|
Регуляторный/Защитный
|
Рисунок 5. Две стороны иммунной системы
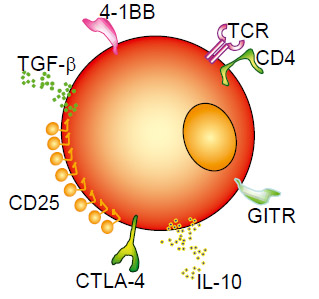
Цитотоксическая часть иммунной системы на первых порах представлена необученной Т-клеткой, не способной что-либо уничтожить (рисунки 6, 7). После ее активации дендритными клетками, и сопутствующими пептидными сигналами, начинается производство армии высокоспецифичных Т-клеток, способных уничтожать клетки, несущие чужеродные антигены (например, опухолевые клетки).В то же время регуляторные Т-клетки, которые подвержены гиперэкспрессии у онкологических больных, защищают опухоль путем снижения воспалительной реакции, уменьшения активации Т-клеток. Существует множество исследований, доказывающих этот факт. И мы должны подавить эту защитную функцию регуляторных Т-клеток любым доступным способом (таблица 1).
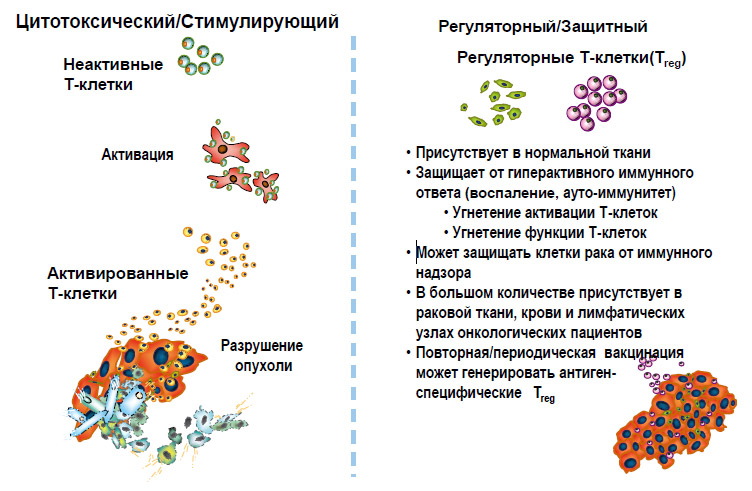
Рисунок 6
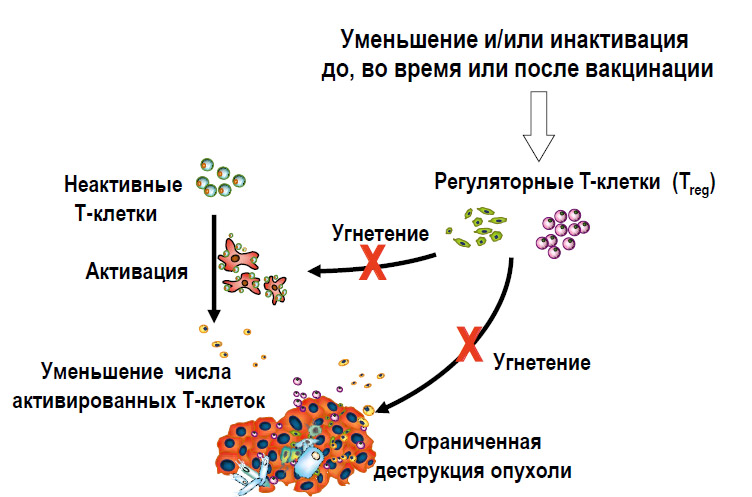
Рисунок 7. Стратегия преодоления Treg-эффекта для повышения эффективности вакцинации от рака
Таблица 1. Агенты для подавления регуляторных Т-клеток
| Агенты | Тип | Цель | Механизм |
|---|---|---|---|
| Anti-CTLA-4 (MDX-10, Medarex) | антитело | CTLA-4 | Блокада |
| Denileukin diftitox (ONTAK®, Ligand) | IL-2 иммунотоксин | CD25 | Направленs ная гибель клеток |
| Anti-CD25, CD4 | антитело | CD25, CD4 | Блокада |
| Anti-41BB | антитело | 41BB | Агонисты/активация |
| Anti-GITR | антитело | GITR | Агонисты/активация |
| Cyclophosphamide (Cytoxan®, Neosar®) |
Pharmaceutical | ? | Селективное уничтожение или инактивация? |
Дендритные клетки (DC) – это наиболее известная и изученная разновидность антигенпрезентирующих клеток. Одно из исследований доктора Demaria – многокогортное исследование на животных, которым имплантировались опухоли в левую и правую почки (рисунок 4). Опухоль в левой почке никогда не подвергалась лечению. Животные разделялись на 4 группы в зависимости от вида лечения, применяемого к правой почке: без лечения; только иммуностимуляция; только облучение; облучение вместе с иммуностимуляцией. Животные из первых двух групп показали примерно одинаковый уровень роста опухоли с обеих сторон. При использовании облучения рост опухоли в правой почке существенно замедлялся. Когда исследователи использовали одновременное облучение одной опухоли и введение аутологичных дендритных клеток, то помимо уменьшения опухоли на стороне воздействия, было зарегистрировано также заметное подавление опухоли на противоположной стороне. Это очень элегантная демонстрация тормозящего эффекта иммунной системы, и в особенности, вовлеченных DC.
Доктор Ablin в 1970 г. в Нью-Йорке отметил неожиданную реакцию отдаленных метастазов после криоабляции рака предстательной железы (РПЖ). Им была задоку-
ментирована регрессия метастазов РПЖ, с локализацией в позвоночнике, после криоабляции простаты. В то время механизм данной реакции остался не раскрытым.
Одно из исследований на крысах со сходным дизайном было опубликовано несколько лет назад. Опухоль спонтанно метастазировала в легкие. После криоабляции опухоли проста- ты была отмечена активизация DC, что сопровождалось замедлением роста легочных метастазов. Животные, которые подвергались криоабляции и введению DC показали лучший профиль выживаемости.
Наша идея состоит в объединении аблятивных и клеточных технологий. Мы верим, что DC служат связующим звеном между лимфоцитами и антигенами опухоли. Однако, в итоге, ответственной за результат иммунной терапии должна быть эффекторная система.
Иммунная система имеет две функции (рисунок 5). Одна из них стимулирующая/цитотоксическая – проявляется путем активации иммунного ответа и усиления активности эффекторов (Т-клетки, В-клетки, антитела), способных к непосредственному уничтожению чужеродных антигенов. Другая, зеркальное ее отражение – это регуляторная/защитная функция, в виде регуляторных Т-клеток, задача которой в ослаблении иммунного ответа. И до тех пор, пока мы не поймем, как эта система работает, мы не сможем регулировать взаимодействие двух противоположных сторон иммунной системы.
Цитотоксическая часть иммунной системы на первых порах представлена необученной Т-клеткой, не способной что-либо уничтожить (рисунки 6, 7). После ее активации дендритными клетками, и сопутствующими пептидными сигналами, начинается производство армии высокоспецифичных Т-клеток, способных уничтожать клетки, несущие чужеродные антигены (например, опухолевые клетки). В то же время регуляторные Т-клетки, которые подвержены гиперэкспрессии у онкологических больных, защищают опухоль путем снижения воспалительной реакции, уменьшения активации Т-клеток. Существует множество исследований, доказывающих этот факт. И мы должны подавить эту защитную функцию регулятор-
ных Т-клеток любым доступным способом (таблица 1).
В США проводятся десятки исследований, направленных на изучение веществ, которые могут подавлять различные звенья иммуносупрессивного влияния регуляторных Т-клеток. Используется множество агентов, основанных на антите-
лах и рецепторах, которые усиливают свойства цитотоксических Т-клеток.
Возвращаясь к аблятивным технологиям: у нас имеется достаточно широкий арсенал средств, которые мы можем использовать, в надежде повлиять на отдаленные мета-
стазы у пациентов очень высокого риска (рисунок 8). Путем разрушения основной опухоли мы можем высвободить широкий профиль антигенов опухоли, затем мы можем активизировать DC пациента для формирования системного иммунного ответа. Последнее, в настоящее время, является предметом интенсивного изучения. Мы также можем использовать несколько стратегий для достижения данной цели, но, пока мы не изменим иммунную среду пациента, этот процесс будет угнетаться.
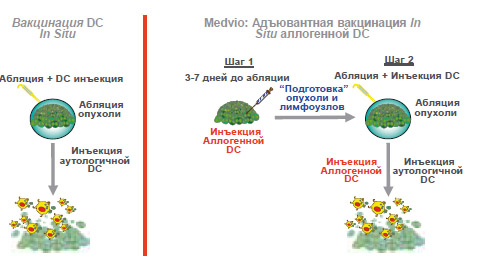
Рисунок 8. Наш подход
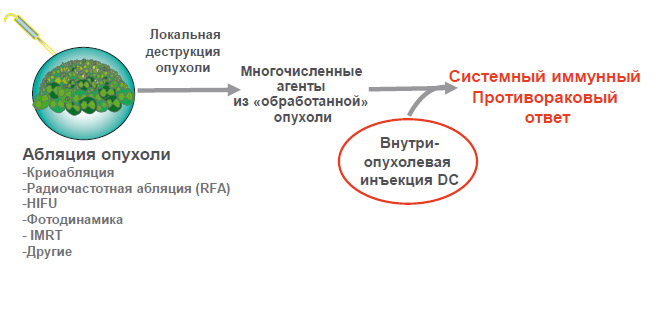
Рисунок 9. Вакцинация DC in situ. Абляция опухоли после внутриопухолевой инъекции DC
Потенциальные преимущества введения дендритных клеток in situ:
- поврежденные ткани опухоли после абляции потенциально могут раскрыть большое разнообразие собственных (аутологичных пациенту) антигенов опухоли, что приводит к генерации поликлонального иммунного ответа;
- нагрузка дендритных клеток антигенами осуществляются in situ, тем самым устраняя необходимость затрат на синтез и обработку антигенов ex vivo;
- абляция играет также и циторедуктивную роль.
Отток жидкости от любой первичной опухоли происходит в местные лимфатические коллекторы. Опухоль растет, прогрессирует, проявляет инвазивные свойства и в изобилии наполняет эти лимфоузлы регуляторными Т-клетками
и иммуносупрессивными факторами, которые предотвращают активацию и нарушают функционирование дендритных клеток и цитотоксических Т-лимфоцитов, снижая тем самым, интенсивность возможного иммунного ответа. И мы долж-
ны в корне изменить эту ситуацию.
Наш подход заключается во введении клеточного адъюванта до операции непосредственно в лимфатическую систему и опухоль (рисунок 9). При этом вследствие реакции Т-клеток на антигенную стимуляцию произойдет высвобож-
дение различных воспалительных цитокинов (Типа 1), включая IFN-α, IFN-γ,TNF-α, IL-2, IL-12, IL-15, и IL- 18. Затем выполняется абляция опухоли тем или иным способом, что приводит к увеличению пула сенсибилизированных клеток и уничто-
жению опухоли. Наличие цитокинов 1 типа локально в ложе опухоли и в дренирующем лимфоузле может обеспечить сигналы к созреванию и активации введенных аутологичных DC, а также к подавлению иммуносупрессивного микроокружения.
Выводы
1. Минимально инвазивные аблятивные технологии обеспечивают весьма актуальный и специфический источник антигенов опухоли, которые потенциально
могут быть использованы в качестве материала для противоопухолевой вакцины, направленной против раковых клеток находящихся далеко за пределами первичной опухоли.
2. Дендритные клетки – как собственные, так и введенные извне – представляют собой ключевой клеточный мост между опухолевыми антигенами и стимуляцией высокоспецифичных цитотоксических Т-лимфоцитов.
3. Чрезмерная ингибирующая функция иммунитета в пораженных областях подавляет специфическую противоопухолевую цитотоксическую активность.
4. Манипуляции с иммунной средой будут необходимыми для реализации потенциала стратегией борьбы против рака при помощи аутовакцин, созданных на основе аблятивных технологий.
5. Использование клеточного адъюванта представляет собой простой и теоретически убедительный метод радикально изменить иммунное микроокружение
в лимфатической системе дренирующей опухоль.
Ключевые слова: рак предстательной железы, дендритные клетки, аблятивные технологии, криоабляция, иммунный ответ.
Keywords: prostate cancer, dendritit cells, ablative technologies, cryoablation, immune response






