Как известно, первоначально лечением опухолей мочеполовых органов занимались хирурги и онкологи. Благодаря усилиям Н.А. Лопаткина было получено официальное разрешение на оказание онкоурологической помощи в урологических стационарах. Это послужило толчком к развитию специализированной онкоурологической помощи в различных урологических клиниках.
Весомый вклад в развитие онкоурологии внес академик РАМН Н.А. Лопаткин, благодаря которому впервые в СССР была разработана и внедрена в широкую клиническую практику брюшная аорто- и селективная артериография при новообразованиях почек.
На этапе становления онкоурологической службы в НИИ урологии выполнялись различные оперативные вмешательства: резекция мочевого пузыря, нефрэктомия, нефруретерэктомия с резекцией мочевого пузыря, внедрялись эндоскопические методы лечения рака мочевого пузыря. Впервые в нашей стране Н.А. Лопаткиным были разработаны и выполнены экстракорпоральные операции на почке, благодаря которым стало возможным радикальное лечение ранее инкурабельных больных с опухолью единственной почки. В этот период в НИИ урологии отмечается постепенный рост числа онкоурологических больных.
У истоков онкоурологического направления в институте стояли такие урологи как А.Ф. Даренков, А.Л. Шабад, В.Г. Горюнов, Э.К. Яненко, Б.М. Крендель, Е.Б. Мазо, В.Я. Симонов. В последние годы большое влияние на становление онкоурологии оказали О.И. Аполихин, С.П. Даренков, И.В. Чернышев, А.Г. Мартов, А.А. Камалов, Ю.В. Кудрявцев, А.В. Сивков, В.Н. Ощепков.
Благодаря трудам этих и других специалистов были разработаны и внедрены в клиническую практику новые методы диагностики и лечения онкоурологических заболеваний.
В последние годы развитие эндоскопической диагностики и хирургии онкоурологических заболеваний неразрывно связана с деятельностью профессора Алексея Георгиевича Мартова, который впервые в нашей стране обосновал в эксперименте и внедрил в клинику технику ряда эндоскопических операций на верхних мочевых путях и явился основоположником суправезикальной эндоскопической хирургии.
Особое место занимает разработка и повсеместное внедрение в России методики определения простат-специфического антигена с целью ранней диагностики и оценки результатов лечения рака предстательной железы, проводившихся при непосредственном участии О.И. Аполихина и А.В. Сивкова.
Одними из первых в стране в НИИ урологии стали применять методы пункционной биопсии и ультразвуковой диагностики при опухолях предстательной железы (А.В. Сивков, В.Н. Ощепков). Впервые в России были апробированы и нашли широкое применение в клинической практике брахитерапия (А.В. Сивков, В.Н. Ощепков), фотодинамическая диагностика заболеваний мочевого пузыря (А.Г. Мартов, А.А. Камалов). Большой вклад в совершенствование и разработку новых методов деривации мочи после радикальной цистэктомии внес С.П. Даренков.
Новый этап развития начался после организации в институте отдела онкоурологии под руководством И.В. Чернышева. В настоящий момент отдел возглавляет А.А. Жернов. Клинической базой отдела является 2-е урологическое отделение. В настоящее время в отделе работают 6 человек. С момента организации научного отдела проводилось дальнейшее совершенствование хирургических методов лечения онкоурологических заболеваний. Были внедрены в клиническую практику системная химиотерапия и фотодинамическая терапия рака мочевого пузыря. Выполнены исследования качества жизни больных после радикальной цистэктомии и кишечной деривации мочи, клинико-морфологические исследования при раке простаты почки и мочевого пузыря, клинико-экспериментальная работа по оценке эффективности и безопасности новых фотосенсибилизаторов.
В настоящее время НИИ урологии является крупным научно-экспериментальным, методическим и лечебным центром, оснащенным новейшим медицинским оборудованием для диагностики и лечения онкоурологических заболеваний, включая интегрированную операционную, эндоскопическое и лапароскопическое оснащение. Это позволяет проводить и большую клиническую работу.
За последние 6 лет в институте значительно увеличилось число онкоурологических больных, количество операций увеличилось с 281 в 2006 г. до 728 – в 2011 г. Сегодня в нашем институте осуществляется весь спектр оперативных вмешательств при онкоурологических заболеваниях (таблица 1).
Таблица 1. Виды онкологических операций
| Виды операций | 2006 | 2007 | 2008 | 2009 | 2010 | 2011 |
| Брахитерапия | 31 | 32 | 28 | 22 | 25 | 30 |
| Открытая нефрэктомия | 31 | 36 | 41 | 45 | 47 | 58 |
| Открытая простатэктомия | 16 | 19 | 21 | 45 | 101 | 110 |
| Радикальная цистэктомия | 16 | 10 | 15 | 20 | 16 | 35 |
| Резекция почки | 21 | 17 | 20 | 13 | 25 | 34 |
| Тур мочевого пузыря при раке | 62 | 76 | 56 | 74 | 110 | 126 |
| Пластика по Брикеру | 14 | 9 | 3 | 19 | 19 | 24 |
| Пластика по Штудеру | 8 | 10 | 11 | |||
| Ретроперитонеоскопическая и лапароскопическая радикальная нефрэктомия | 13 | 25 | 30 | |||
| Экстраперитонеоскопическая радикальная простатэктомия | 9 | 22 | 49 | |||
| Фотодинамическая терапия рака мочевого пузыря | 16 | 21 | 22 | 18 | 21 | 26 |
| HIFU при раке предстательной железы | 4 | 42 | 32 | |||
| Криоабляция при раке предстательной железы и почки | 10 | 5 |
Вместе с этим, в последние годы неуклонными темпами развиваются современные лапароскопические и малоинвазивные технологии.
В настоящее время приоритетными задачами для развития онкоурологического направления являются следующие:
- изучение биологии опухолевой клетки, механизмов канцерогенеза и опухолевой прогрессии;
- изучение предопухолевых состояний и разработка методов их коррекции с целью активной профилактики развития рака;
- дальнейшая разработка и внедрение новых малоинвазивных технологий для лечения злокачественных опухолей (брахитерапия, криоабляция, HIFU-терапия, лапароскопическая техника операций, фотодинамическая терапия);
- разработка новых средств и методов диагностики, лекарственной и комбинированной терапии опухолей;
- стандартизация и фармакоэкономическое обоснование оказания высококвалифицированной медицинской помощи больным со злокачественными новообразованиями;
- внедрение и совершенствование новых методов лечения осложнений у онкоурологических пациентов;
- проведение клинических исследований по эффективности и безопасности новых современных препаратов для лечения опухолевых заболеваний мочеполовой системы.
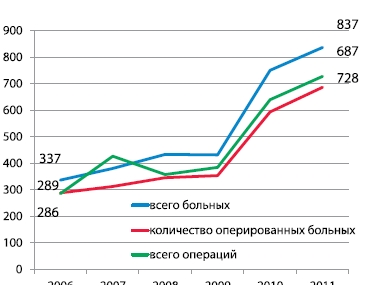
Рисунок 1. Динамика числа онкоурологических больных в НИИ урологии
По проблемам рака предстательной железы (РПЖ) в институте проводится работа по следующим направлениям:
- профилактика развития РПЖ;
- развитие методов ранней диагностики;
- совершенствование и внедрение новых методов визуализации;
- внедрение и развитие малоинвазивных технологий лечения локализованных форм РПЖ;
- изучение эффективности комбинированного лечения распространенных форм РПЖ;
- изучение маркеров клинического течения гормонорезистентного и распространенного РПЖ.
По проблеме злокачественных новообразований почки и мочевого пузыря основными направлениями исследований являются развитие лапароскопической хирургии, методов фотодинамической терапии, флуоресцентной диагностики и флуоресцентной навигации при выполнении нефронсберегающих и радикальных операций, изучение новых препаратов и режимов для БЦЖ-терапии.
Одним из перспективных направлений является исследование по химиопрофилактике рака предстательной железы при наличии простатической интраэпителиальной неоплазии препаратом, содержащим индол-3-карбинол (I3C) и эпигаллокатехин-3-галлат (EGCG), в котором было показано статистически значимое снижение частоты выявления ПИН после 6 месяцев применения этого препарата (рисунок 2).
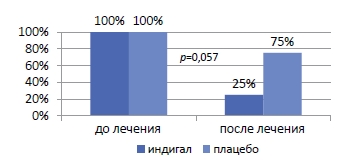
Рисунок 2. Результаты профилактики РПЖ на фоне применения комплекса I3C и EGCG
Также было проведено исследование по профилактике развития простатической интраэпителиальной неоплазии при терапии ингибиторами 5альфа-редуктазы. Показано достоверное уменьшение частоты развития ПИН при применении этих лекарственных средств (рисунок 3).
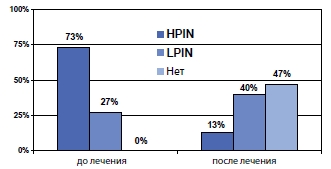
Рисунок 3. Частота PIN на фоне терапии финастеридом
Для повышения эффективности ранней диагностики РПЖ в настоящее время проводится исследование по определению наиболее специфичной и чувствительной комбинации ряда молекулярных маркеров.
Среди исследуемых маркеров – глутатион-S-трансфераза класса π1, рецептор ретиноевой кислоты, белок семейства доменов, ассоциированных с RAS, РНК-маркер (транскрипт химерного гена). В исследование включено 157 мужчин с различными заболеваниями предстательной железы.
При изучении материала, полученного из предстательной железы и образцов мочи, выявлено, что показатели чувствительности и специфичности этой комбинации маркеров составили 86 и 76% (таблица 2).
Таблица 2 . Характеристика диагностической системы маркеров РПЖ, вычисленная по образцам ДНК, выделенных из ткани предстательной железы и мочи, полученной после массажа предстательной железы
| Маркер | Чувствительность | Специфичность | +PV | -PV | Диагностическая точность | |||||
| Биоптат | Моча | Биоптат | Моча | Биоптат | Моча | Биоптат | Моча | Биоптат | Моча | |
| Метилирование промоторной области гена GSTπI; | 85,1% | 81,9% | 69,7% | 36,8% | 85,1% | 90,4% | 30,3% | 78,1% | 98,2% | 96,3% |
| Метилирование промоторной области гена RARβ2 | 85,9% | 64,2% | 75,0% | 40,0% | 85,9% | 88,0% | 25,0% | 86,0% | 94,0% | 91,7% |
| Метилирование промоторной области гена RASSF1A | 87,9% | 71,3% | 85,3% | 57,1% | 92,1% | 88,5% | 21,6% | 69,8% | 96,6% | 92,8% |
| Суммарно | 86,3% | 72,5% | 76,7% | 44,6% | 87,7% | 89,0% | 25,6% | 78,0% | 96,3% | 93,6% |
Показатели несколько хуже при изучении значимости этих маркеров в образцах, полученных из крови. Тем не менее, при сравнении диагностических характеристик этих маркеров (GST π1, RARβ2 и RASSF1A) и ПСА, специфичность изученной диагностической панели превосходит специфичность ПСА (61,7% vs 5%, р < 0,05) (таблица 3).
Таблица 3. Характеристика диагностической системы маркеров РПЖ, вычисленная по образцам ДНК, выделенных из цельной крови и лимфоцитов
| Маркер | Чувствительность | Специфичность | +PV | -PV | Диагностическая точность | |||||
| Кровь | Лимфоциты | Кровь | Лимфоциты | Кровь | Лимфоциты | Кровь | Лимфоциты | Кровь | Лимфоциты | |
| Метилирование промоторной области гена GSTπI; | 61,2% | 64,9% | 60,9% | 61,5% | 90,1% | 89,5% | 78,8% | 74,2% | 88,2% | 91,9% |
| Метилирование промоторной области гена RARβ2 | 61,6% | 62.6% | 38,1% | 57,7% | 87,6% | 88,2% | 84,6% | 76,6% | 86,0% | 84,6% |
| Метилирование промоторной области гена RASSF1A | 12.6% | 10,6% | 51,6% | 65,8% | 86,5% | 86,6% | 64,2% | 58,3% | 82,3% | 85,8% |
| Суммарно | 67,1% | 66,0% | 52,2% | 61,7% | 88,1% | 88,1% | 75,9% | 69,7% | 85,5% | 87,4% |
Следующим направлением работы онкоурологической службы института явилась разработка панели маркеров прогнозирования клинического течения гормонорезистентного рака простаты. Как известно, в настоящее время существует единый алгоритм обследования пациентов РПЖ, который позволяет, используя разработанные номограммы (Партин, Каттан и др.) с высокой долей вероятности установить стадию опухолевого процесса, а также с высокой точностью прогнозировать риск поражения лимфатических узлов и семенных пузырьков, вероятность распространения опухоли за пределы капсулы предстательной железы, 5-летнюю безрецидивную выживаемость после различных способов лечения и течение болезни после применения спасительной лучевой терапии. Однако, несмотря на эти достижения, еще остается много неясных вопросов, а именно риск развития у пациента кастрационно-рефрактерного рака предстательной железы (КРРПЖ).
Сегодня ряд зарубежных исследований позволяют предполагать, что наличие нейроэндокринной дифференцировки (НЭД) РПЖ является прогностическим маркером КРРПЖ. Кроме того, считается, что присутствие НЭД позволяет предполагать степень риска метастазирования и рецидивирования РПЖ после радикального лечения. Наиболее важным маркером для определения НЭД РПЖ является хромогранин А (ХгА). Ценность определения НЭД пока не выяснена до конца. Ряд зарубежных авторов считает, что наряду с такими стандартными тестами как ПСА, сумма баллов по шкале Глисон, количество позитивных столбиков, определение НЭД опухоли может стать необходимым для комплексного подхода в определении прогноза и в выборе тактики лечения РПЖ.
В НИИ урологии проводится ряд исследований, которые позволят изучить встречаемость НЭД при локализованном, метастатическом, КРРПЖ, сравнить экспрессию этого и других маркеров при РПЖ, ДГПЖ и ПИН на основании определения тканевого и сывороточного уровней.
В другом исследовании изучается уровень тканевого ХгА у пациентов с КРРПЖ, которым в дальнейшем будет назначена терапия аналогами соматостатина с изучением эффективности терапии. В настоящее время эффективность комбинированной терапии с использованием андрогенной депривации и аналогов соматотропного гормона оценена у 30 пациентов. Снижение ПСА достигнуто у 12 (40%) пациентов, стабилизация ПСА – у 6 (20%) человек, а рост ПСА отмечен у 12 (40%) мужчин из числа включенных в исследование.
Еще одним направлением исследований является внедрение и разработка современных методов визуализации, одним из которых является эластография. Изучена диагностическая точность этого метода для принятия решения о необходимости биопсии предстательной железы. Всего обследовано 30 пациентов в возрасте от 45 до 80 лет с уровнем ПСА сыворотки крови 4-10 нг/мл.
Биопсия предстательной железы выполнялась двумя независимыми специалистами. Вначале врач, обученный работать в режиме эластографии, проводил ультразвуковое сканирование и биопсию простаты из 2-4 «таргетных» точек под контролем эластографии. Затем другой врач, выполнял трансректальную биопсию простаты из 14 точек под УЗ-контролем в В-режиме. Критерием оценки было сравнение результатов гистологического исследования биопсийного материала взятого под контролем соноэластографии и результатов гистологического исследования биопсийного материала, взятого при расширенной биопсии простаты. Стандартная биопсия предстательной железы из 14 точек позволила определить РПЖ у 8 пациентов (26,7%). Биопсия, выполненная под контролем эластографии только из «таргетных» зон, выявила РПЖ у 4 пациентов (13,3%), среди них был 1 пациент, у которого РПЖ не был выявлен при стандартной биопсии. Неоднозначность полученного результата диктует необходимость продолжения исследований.
Еще одной новой технологией, впервые внедренной в клиническую практику НИИ урологии, стала новейшая диагностическая система определения рака предстательной железы – HistoScanning. Это компьютерная система предназначена для обнаружения подозрительных на рак образований в предстательной железе. Она основывается на цифровой обработке информации, полученной от ультразвукового сканера, и показывает расположение, форму и объем опухолевого поражения предстательной железы. Алгоритм HistoScanning разработан на основании анализа корреляции «сырого» ЭХО сигнала с результатами патогистологических исследований после РПЭ.
Как известно, выявляемость рака предстательной железы с использованием стандартной ультразвуковой навигации оставляет желать лучшего. Частота ложноотрицательных результатов при стандартной ТРУЗИ-биопсии составляет 20-30%, систематически пропускаются поражения передней части предстательной железы, средней линии и апекса. В НИИ урологии выполнено исследование точности template-биопсии при HistoScanning-навигации. Исследовано 18 пациентов с негативными биопсиями в анамнезе (от 1 до 7). Количество образцов ткани варьировало в пределах 12-28 столбиков и зависело от объема предстательной железы. Средний объем железы составил 55,8 (11,2-92,4) мл, средний возраст пациентов был 64,4 (44-81) лет, среднее значения ПСА – 7,3 (3,8-11,8) нг/мл. В результате применения template-биопсии у 7 из 18 пациентов был обнаружен РПЖ, а у 8 – наличие ПИН высокой или низкой степени. Это позволило сделать следующие выводы:
- HistoScanning повышает вероятность обнаружения опухоли предстательной железы при биопсии;
- возможно уменьшение количества вколов без снижения чувствительности биопсии;
- метод имеет перспективы для использования при фокальной терапии РПЖ;
- может применяться для контроля пациентов, выбравших «Динамическое наблюдение», и для оценки эффективности органосохраняющих вмешательств.
Одним из направлений работы отдела является изучение возможностей комбинированного лечения местно-распространенных стадий РПЖ. Комбинация включает в себя тримодальное лечение:
- 1 – неоадъювантную гормональную терапию;
- 2 – последующее оперативное лечение в объеме радикальной простатэктомии;
- 3 – адъювантную дистанционную лучевую терапию.
В настоящее время в исследование включены 33 человека, из них все 3 этапа лечения проведены у 15 пациентов, у 7 – первые 2 этапа, остальным проводится неоадъювантная гормональная терапия. По предварительным результатам выявлено, что у всех больных достигнут положительный эффект ГТ: снижение уровня ПСА, уменьшение инфравезикальной обструкции, уменьшение объема предстательной железы. Частота побочных эффектов от гормональной терапии не превышала описанных в литературе; выраженность побочных эффектов не потребовала отмены гормонотерапии ни в одном наблюдении. Во время оперативного лечения отмечен выраженный положительный эффект предшествующей ГТ:
- уменьшение размера предстательной железы за счет редукции опухоли и сопутствующей ДГПЖ;
- отсутствие макроскопических признаков местного распространения за капсулу простаты;
- более легкое техническое выполнение операции с возможностью сохранения важных нервно-мышечных и сосудистых структур.
В послеоперационном периоде наблюдалось раннее восстановление удержания мочи за счет отмеченной выше возможности сохранить СНП.
Таким образом, можно сделать следующие предварительные выводы.
- Комбинированное лечение местно-распространенных стадий РПЖ обладает клинической эффективностью, низким числом осложнений, хорошими функциональными результатами и отсутствием неблагоприятного воздействия на качество жизни пациентов.
- Необходимо дальнейшее изучение и накопление данных о возможности применения мультимодального подхода к лечению местно-распространенных стадий рака простаты.
- В дальнейшей оценке нуждается онкологическая эффективность (при достаточном сроке наблюдения за больными), и фармакоэкономическая эффективность.
Немаловажным по объему внедрения направлением в НИИ урологии является освоение малоинвазивных технологий, к которым относятся:
- внутритканевая лучевая терапия опухолей мужских половых органов (брахитерапия) – применяется с 2000г.;
- фотодинамическая терапия новообразований мочевого пузыря – применяется с 2008 г.;
- высокоинтенсивная фокусированная ультразвуковая терапия рака предстательной железы (HIFU) – применяется с 2009 г.;
- криоабляция новообразований предстательной железы и почки – применяется с 2010г.
За последние 2 года в институте получены следующие результаты:
- внедрена методика выполнения, определены показания и противопоказания для HIFU и криоабляции предстательной железы при локализованном и местно-распространенном раке простаты;
- внедрена методика криоабляции при РПЖ и малых опухолях почки;
- разработаны критерии отбора для HIFU-терапии при впервые выявленном раке предстательной железы и для больных с местным рецидивом после радикального лечения;
- разработана методика послеоперационного ведения и дальнейшего наблюдения пациентов после выполнения процедуры криоабляции;
- производится сбор собственных данных для сравнительной оценки эффективности и безопасности малоинвазивных методов лечения, а также функциональных результатов и влияния на качество жизни пациентов с онкопатологией;
- отчеты по проведенным процедурам, включая клинические случаи, опубликованы на web-ресурсах, выполнены доклады на тематических конференциях и VI Конгрессе онкоурологов;
- проведены две конференции и круглый стол по малоинвазивным технологиям в онкоурологии.
Следующим направлением исследований было изучение возможностей фотодинамической диагностики опухолей почки в эксперименте и клинике. Как известно, экспресс-биопсия во время операции не является точным критерием оценки радикальности операции (отсутствует возможность четкой визуализации опухоли в крае резекции), т.к. биопсия берется случайным методом. Разработка методик, позволяющих визуализировать опухоль и производить более точную биопсию из подозрительных участков, очень актуальна в настоящее время. В связи с этим выполняется разработка методики фотодинамической диагностики (ФДД) рака почки с использованием отечественного фотосенсибилизатора Аласенс и оценки ее эффективности. Изучаются следующие параметры:
- обычное свечение (аутофлуоресценция) нормальной почечной ткани;
- флуоресценция здоровой почечной ткани на фоне приема фотосенсибилизатора;
- флуоресценция опухоли без и с введением фотосенсибилизатора, а так же флуоресценция воспаленной почечной паренхимы с и без введения фотосенсибилизатора;
- сопоставление с результатами гистологического исследования;
- интраоперационная визуальная оценка свечения опухоли.
Полученные предварительные результаты свидетельствуют:
- препарат Аласенс в значительной степени накапливается в опухолевой ткани по сравнению с нормальной почечной паренхимой и интенсивность флуоресценции в опухолевой ткани значительно выше;
- метод позволяет определить радикальность выполненного оперативного лечения путем визуализации края резекции;
- установлена высокая диагностическая эффективность фотодинамической диагностики в уточнении границ основного и выявлении дополнительных первичных очагов опухоли, подтвержденная гистологически;
- чувствительность метода составила 85-100%, специфичность – 63-78%.
Подобным же образом производится изучение возможностей интраоперационного фотодинамического контроля радикальности простатэктомии. Прооперировано 45 больных с локализованным и местно-распространенным РПЖ. 15 больным выполнена лапароскопическая (экстраперитонеоскопическая) и 30 – открытая позадилонная простатэктомия. Перед операцией пациентам перорально вводился Аласенс из расчета 20 мг/кг массы тела. После удаления железы проводится оценка флуоресцентного эффекта в области ложа предстательной железы, шейки мочевого пузыря и задней уретры с помощью специального аппарата и компьютерной программы LESA-Soft 9. Чувствительность метода в общей группе больных составила 62%, специфичность – 86% (таблица 4).
Таблица 4. Результаты применения фотодинамической навигации при выполнении радикальной простатэктомии
| Общая группа n = 45 (100%) | Лапароскопическая группа n = 15 (33%) | Открытая группа n = 30 (67%) | |
| Ложно-позитивное свечение | 4 (9%) | 2 (13%) | 2 (6%) |
| Ложно-отрицательное свечение | 6 (13%) | 2 (13%) | 4 (12%) |
| Чувствительность, % | 62 | 60 | 64 |
| Специфичность, % | 86 | 80 | 90 |
Важной задачей НИИ урологии в целом, и онкоурологического отдела в частности, является организация и проведение локальных и международных клинических исследований.
Научные сотрудники института неоднократно участвовали в проведении международных и межрегиональных многоцентровых рандомизированных исследований.
На протяжении последних лет активно изучались препараты для лечения РПЖ, рака почки и мочевого пузыря. С особым вниманием в отделе относятся к разработке и внедрению лекарственных препаратов отечественного производства. Так, за последние годы при непосредственном участии сотрудников отдела были разработаны, апробированы и внедрены в урологическую практику такие высокотехнологичные импортозамещающие лекарственные препараты и диагностические системы, как Бусерелиндепо, Октреотид-депо (аналог соматостатина), Резорба (золедроновая кислота), Октреоскан, Резоскан и др.
Проводится работа по внедрению в практику института методов местной и системной химиотерапии злокачественных новообразований, что позволяет проводить комплексное лечение больных данной категории.
Число публикаций за время работы онкоурологической службы НИИ урологии превысило 1400, сотрудники института и отдела принимали участие в написании 11 монографий, выпуске изданий на электронных носителях информации. На базе института защищены 6 докторских и 20 кандидатских диссертаций по проблемам онкоурологии.
Таким образом, онкоурологическая служба НИИ урологии имеет давние традиции, хорошую школу, богатый научный и клинический опыт. Свято храня традиции наших учителей и предшественников, наш отдел будет развивать и расширять свою полезную деятельность на благо отечественной медицинской науки и способствовать развитию онкоурологии как научной и клинической дисциплины.
Ключевые слова: онкоурология, рак предстательной железы, рак почки, диагностика, панель маркеров, эластография, гистосканирование, лечение, брахитерапия, криоабляция, HIFU-терапия, лапароскопическая техника операций, фотодинамическая терапия, фотодинамическая навигация.
Keywords: oncourology, prostate cancer, kidney cancer, diagnosis, marker panel, elastography, histoscaning, treatment, brachytherapy, cryoablation, HIFU-therapy, laparoscopic surgery, photodynamic therapy, photodynamic navigation.






